Portaalsite voor de échte zeeaquariaan
De pH waarde (2)
De pH waarde. (2)
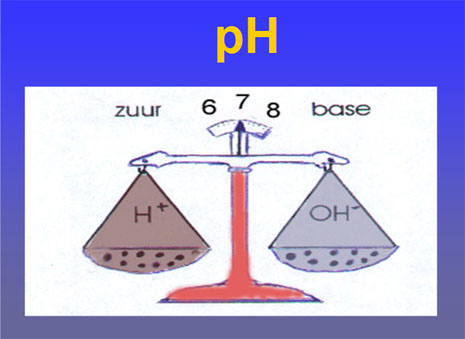
De exacte definitie van pH is de cologarithme van de waterstofionen concentratie. Zijn er bijvoorbeeld 10-4 H+-ionen aanwezig per liter, dan is de logaritme –4 en dus de cologarithme of de pH 4.Wat wil dit nu zeggen?De pH geeft ons een idee over de hoeveelheid waterstofionen. (vrije niet gebonden waterstof atomen) Water ( of H2O) bestaat uit H+ ionen en OH- ionen.
De exacte definitie van pH is de cologarithme van de waterstofionen concentratie. Zijn er bijvoorbeeld 10-4 H+-ionen aanwezig per liter, dan is de logaritme –4 en dus de cologarithme of de pH 4.Wat wil dit nu zeggen?De pH geeft ons een idee over de hoeveelheid waterstofionen. (vrije niet gebonden waterstof atomen) Water ( of H2O) bestaat uit H+ ionen en OH- ionen.Bij zuiver water ( neutraal) zijn er evenveel H+ als OH- ionen aanwezig. Wanneer er meer H+ ionen zijn dan spreken we van een zuur. Een overwicht van de OH- ionen geeft een base. In zeewater zijn er meer OH- ionen in het water, vandaar dat het water niet zuur maar basisch is.Er zijn wiskundige afspraken gemaakt om de hoeveelheid H+ ionen en OH- ionen op een eenvoudige schaal te plaatsen. Een pH van 7 noemen we neutraal.
Wanneer er basische of zure stoffen op het water inwerken wordt de balans tussen H+ ionen en de OH- ionen verstoord. Het water reageert dan zuurder of basisch. ( Alkalisch).
Bij zeewater ligt de pH normaal op 8,2. In de zee worden er elke dag zuren en basen aangevoerd zonder dat de pH waarde echt verandert. Waar zich dan toch kleine veranderingen voordoen komt de pH na enige tijd terug op 8,2. Men zegt dan dat het water een buffercapaciteit of een bufferend vermogen heeft.Bij dit bufferende vermogen speelt ook koolstofdioxide (CO2) een grote rol. Een toename van het CO2 gehalte doet het zeewater zuurder worden. In een rifaquarium met een sterke verlichting is de opname ( verbruik ) van CO2 zo groot dat de pH ’s morgens 8,1 kan zijn en ’s avonds tot 8,4 of nog hoger kan oplopen als alle CO2 geconsumeerd is.De oorzaak hiervan is te vinden in het zéér grote verbruik van koolzuur (H2CO3) ofwel een lage ( of geen ) productie van CO2. Dit kan alleen in een zeeaquarium zonder vissen en heel veel wieren. Ervaringen met een groot wierenbestand ( grote Caulerpa velden ) in combinatie met droog nat filters zijn bekend. Deze oorzaken hier vermeld wegnemen is de enige methode die veilig is. CO2 toevoegen is alleen toelaatbaar onder ideale meet- en controle omstandigheden.
Wanneer je dit doet moet je wel beseffen dat die CO2 eerst het bufferende vermogen van je aquarium zal doen dalen voor dat de pH ook maar één tiende zal dalen. Volg dus nauwgezet de KH.Bij een te lage pH ( ’s avonds na 12 uur belichting ) moet men de oorzaak zoeken in het overmatig aanwezige koolzuur in het aquariumwater en/of een extra bron van CO2.Een grote afschuimer blaast grote hoeveelheden omgevingslucht in het water. Een injector van zo een grote afschuimer blaast 300 liter lucht/ per uur in het water. Van die lucht is 0,1 % CO2 ( in onvoldoende verluchte lokalen 0,5 % ). Die CO2 wordt in koolzuur omgezet.
Dankzij het bufferend vermogen wordt CO2 grotendeels omgezet in bicarbonaat.(HCO3) Kan ook rechtsreeks gebeuren door reactie met OH-Is de visbezetting ( het zijn CO2 producenten) groot of zijn wieren noch lagere dieren aanwezig in een voldoende verlicht aquarium, dan zal de pH onvermijdelijk te laag worden. In zo een geval zal het bufferend vermogen ( uitgedrukt in KH) ook te laag zijn.Bacteriën recycleren en ze vormen ook in mindere mate schadelijke producten. Er worden voornamelijk zuren gevormd. Dagelijks komen er H+ ionen bij.
De balans zal aan de kant van de H+ overhellen, ons pH dag gemiddelde zal zakken van 8,2 naar 8,1 en in de richting naar 7 opschuiven. Waarom komt het zo ver niet?Omdat we in ons zeewater bicarbonaten ter beschikking hebben. Het zijn deze buffers die de dagelijkse aanvoer H+ ionen opnemen. De bicarbonaten nemen de H+ ionen op en vormen op hun beurt een andere stof. Meet je de bicarbonaten dan zal je zien dat deze verminderd zijn. De KH zal dus dalen.Met andere woorden eerst zal ons bicarbonaat verbruikt worden en de pH blijft voorlopig nog stabiel. Was tijdens de opstart een waarde KH 10 tot 15 geen rariteit, nu zal je zien dat je maar KH 6 tot 7 meet.
Zolang er bicarbonaten beschikbaar zijn zullen de zure H+ ionen niet op de weegschaal terechtkomen en onze pH zal rond de 8,2 blijven.
Besluit: Is de KH boven de 8 dan zal ook de pH rond de 8,2 blijven, en je moet je over de pH geen zorgen maken.
In de meeste rif aquaria is door regelmatige waterverversing de aanvoer van “verse” bicarbonaten voldoende. Ook zullen de zuurmakende H+ protonen een aantrekking hebben op kalkhoudende gesteenten. Dit verschijnsel is goed bekend wanneer een druppel zuur op een kalkhoudende steen valt. Het zuur lost de steen op en de druppel verdwijnt. In beperkte mate is dit ook zo in ons zeeaquarium. Dit op voorwaarde dat de stenen of koraalzand in de filter niet bedekt zijn met een laagje bacteriën of ander beschermende stoffen. Dat is in de praktijk meestal wel het geval. Een zandbodem daarentegen is bijna altijd beschikbaar.
















