Portaalsite voor de échte zeeaquariaan
Ontwikkeling en kweek van haarsterren
Ontwikkeling en kweek van haarsterren
(Door Tomoka Shibata, Ph.D. – website CoralScience - vertaling Rien van Zwienen redacteur ReefSecrets)
Haarsterren behoren tot de klasse van crinoidea zonder stelen, die verschillend is van de zeelelies (crinoidea met stelen) die hun hele leven stelen hebben (fig.1).
Er zijn meer dan 500 soorten haarsterren in de wereld en de dieptes van hun leefgebied variëren van kuststrook tot verschillende duizenden meters diepte. Volgens de taxonomie, behoren de crinoidea tot de echinodermata samen met de zee-egels, zeesterren, borstelwormen en zeekomkommers. Het lichaam van een haarster laat een vijfradialige symmetrie zien, wat een van de bepalende kenmerken van de echinodermata is.
Figuur 1: Een 8 maanden oude Oxycomanthus japonicus.
Haarsterren zijn dieren die op de bodem leven (bentisch). Zij hangen meestal met wortelachtige uitsteeksels, cirri genaamd (fig.2), aan een hard substraat zoals koralen en rotsen. Over het algemeen verplaatsen ze zich niet actief, maar als het nodig is kunnen kruipen ze met hun cirri om hun microwereldje te veranderen. Een van opvallende structuren van een haarster zijn de armen. Een haarster heeft 10 tot 120 armen, en het aantal verschilt tussen de verschillende soorten en verandert gedurende de verschillende groei stadia; van uit de centrale schijf steken vijf armen die ieder een of meerdere malen vertakt. Iedere arm heeft pinnules die van beide zijkanten uitsteken.
Armen en pinnules zijn organen voor de voeding en beweging. Zij hebben goed ontwikkelde spieren, ligamenten en zenuw banen. Haarsterren zijn suspensie eters, die planktonachtige organismen zoals diatomeeën, foraminiferen, kleine crustacea en jonge schelpachtigen, zowel als organische deeltjes eten (Rutman en Fishelson 1969, Kitazawa et al 2007). Het meeste voer dat een haarster eet is kleiner dan 400 μm in grootte (Rutman en Fishelson 1969). Een haarster vangt voedsel met buisvormige voeten die zich langs de pinnules bevinden (fig.3, midden). Mucus dat uitgescheiden wordt door de buisvormige voeten dient als val voor het voedsel (Nichols,1960). Voedsel groeven lopen langs het oppervlak van pinnules en armen en leiden uiteindelijk naar de mond die in het middelste gedeelte van het lichaam zit (fig. 3, rechts). Het gevangen voedsel wordt langs deze groeven naar de mond vervoerd. Het vertering kanaal zit in het centrale deel van het lichaam en de anus opening zit dicht bij de mond (fig.3, rechts).

Figuur 2: Haarsterren bevestigen zich zelf aan rotsachtig substraat door middel van beweegbare aanhangsels, “cirri”genaamd.
Een haarster heeft een kalkachtig skelet dat uit smalle platen bestaat, en iedere plaat is door middel van korte spieren en ligamenten verbonden. Zulke structuren voorzien het dier van de nodige mobiliteit en flexibiliteit.
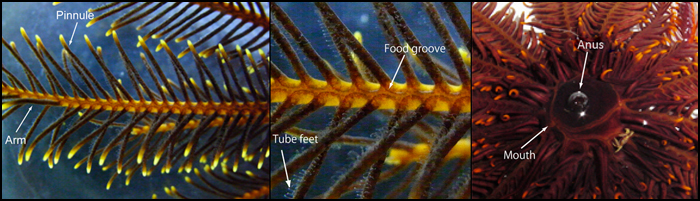
Figuur 3: De verschillende anatomische structuren van een haarster.
Links: een arm met uitstekende pinnules. Midden: vergroting van een arm. Een voedsel groef loopt langs de arm en pinnules. Kleine slangachtige voetjes zijn verdeeld over de pinnnules. Deze pinnules vergroten het oppervlak van de arm behoorlijk, wat de buisvormige voetjes in staat stelt zeer effectief plankton te vangen. Rechts: Beeld van de onderkant van de centrale schijf van een haarster. Voedsel groeven komen bij de mond uit. De mond en anus zijn, dichtbij elkaar, in de centrale schijf gelokaliseerd (foto’s Fumiaki Sodeyama en Dr. Tomoko Shibata).
Vermenigvuldiging en ontwikkeling
- Eier-uitstoting
De meeste haarsteren hebben een duidelijk geslacht, wat betekent dat er zowel mannelijke als vrouwelijke dieren bestaan. In iedere pinnule, die zich ongeveer in het middelste gedeelte van de arm bevind, ontwikkelt zich een gonad. Zij stoten sperma of eieren uit vanuit de gonad en de bevruchting gebeurt in het zeewater. Er zijn van soort tot soort bij vrouwtjes wat variaties in de manier van het uitstoten van eitjes. Bij sommige soorten, stoot het vrouwtje haar eieren gelijktijdig uit. Bij andere soorten, stoot het vrouwtje in meerdere keren kleine hoeveelheden eitjes uit. Na het uitstoten wapperen sommige soorten met hun armen om de eieren te verspreiden terwijl sommige de eieren laten vastzitten aan de pinnules (Holland 1991).

Figuur 4: Het eier-uitstoten van een vrouwelijke O. japonicus. De eieren worden van iedere gonad, die in iedere pinnule zit uitgestoten. Na het eier-uitstoten, zwaait het vrouwtje met de armen en verspreid de eieren in het zeewater.
Wat betreft de Oxycomanthus japonicus, een uitgebreid bestudeerde soort in Japan, gebeurt de eier-uitstoting eens per jaar, op de avond van doodtij in de tweede helft van oktober. De eier-uitstoting van O. japonicus is te zien in fig.4. Vergelijking tussen de eier-uitstoting data tussen 2000-2006 en die tussen 1937-1955 laat zien dat in de laatste 60 jaar de eier-uitstoting een doodtij cyclus verder verschoven is. Dit fenomeen zou te maken kunnen hebben met een stijging van de zeewatertemperatuur, omdat dit de snelheid van seksueel volwassen worden en timing van het eier-uitstoten beïnvloed. Omdat er geen data van zeewatertemperaturen tussen 1937-1955 beschikbaar waren, heeft ons team de data vergeleken tussen 2000-2006 en die tussen 1964-1973, de oudste periode waarvan metingen beschikbaar waren. De analyses laten zien dat de gemiddelde zeewatertemperatuur in september en oktober significant is toegenomen gedurende die 40 jaar (fig.5).
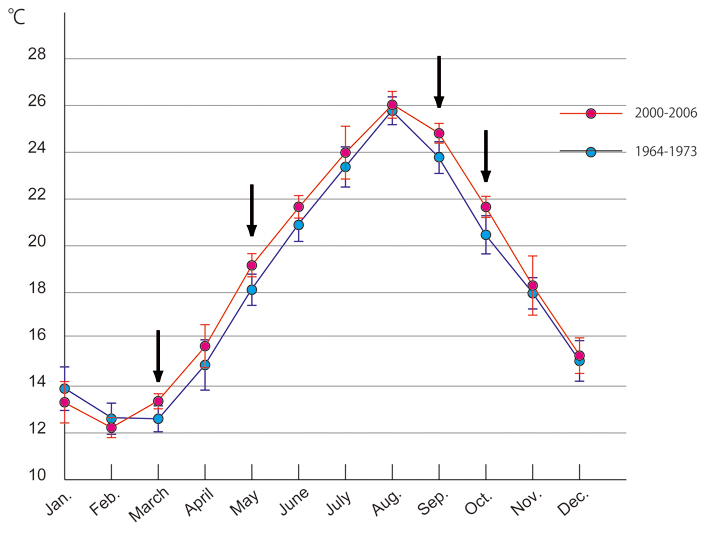
Figuur 5: Maandelijkse vergelijking van zeewater temperaturen
(op 1 meter diepte) tussen de periode van 1964-1973 (blauwe lijn) en die van 2000-2006 (rode lijn). Gemiddelde zeewater temperaturen in maart, mei, september en oktober van 2000-2006 waren significant hoger dan die van 1964-1973 (pijlen, p<0.01;T-test).
Het is empirisch aangetoond dat de dieren geneigd zijn eieren uit te stoten nadat de zeewater temperatuur gedaald is tot beneden 22°C (Kubota, 1988), en het is mogelijk dat een verhoging van de zeewater temperatuur deze vertraging van de eier-uitstoting heeft veroorzaakt (Shibata et al. 2008).
Recentelijk is het bestaan van een hermafrodiete haarster Dorometra sesokonis gerapporteerd (Obuchi et al. 2008). Bij deze soort heeft een volwassene zowel een ovarium als testikels. Dit rapport laat bij haarsterren een nieuwe manier van reproductie zien.
- Ontwikkeling
Wat betreft de O. japonicus, ongeveer 16 uur na de bevruchting komen de larven uit de eieren en beginnen in het zeewater te zwemmen. De lichaamsvorm van een zwemmende larve, doliolaria genaamd), ziet er uit als een bolletje (fig.6, links). De doliolarian fase duurt een paar dagen, waarna zij zich hechten op een substraat en zich omvormen van een bilateraal lichaam naar een pentaradiaal lichaam.
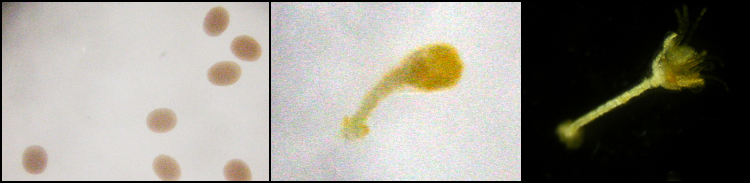
Figuur 6: Ontwikkeling stappen van haarsterren. Links: doliolaria. Midden: cystidea na het hechten en de omvorming. Rechts: pentacrinoide met geopende mond.
Na deze fase worden ze cystidea (fig. 6, midden) genoemd. Ongeveer een week na het hechten, openen ze hun mond aan de bovenkant van hun lichaam en beginnen zich te voeden. Vanaf dit moment, worden ze pentacrinoidea genoemd (fig. 6, rechts). Een aantal dagen na het openen van de mond, groeien er 10 armen (fig.7,links). En wel, vijf armen die beginnen bij de centrale schijf en die zich ieder eenmaal vertakken. Zij vertonen de eerste twee maanden een sessiel gedrag, hierna verbreken ze de steel en beginnen een vrij zwevend leven (fig.7, rechts).

Figuur 7. Links: Pentracrinoide met 10 armen. Rechts: jong na het losmaken van zijn steel.
Bij veel soorten blijft het aantal van 10 armen gedurende hun leven stabiel. Echter, bij sommige soorten neemt het aantaal armen toe in hun ontwikkelingsproces. Bij O.japonicus begint 6 maanden na de bevruchting de toename. Zij knijpen spontaan een originele arm bij het aangrijpingspunt af (dicht bij de centrale schijf) en gooien het weg. Hierna groeien er vanuit dit punt twee armen. Op deze manier wordt een originele arm vervangen door twee nieuwe armen (fig.8, links). Dit wordt vertakkende regeneratie genoemd. Het gebeurd niet simultaan bij alle armen, maar meestal de een na de ander (fig. 8, rechts, Shibata and Oji 2003). Gedurende een aantal maanden gaat dit afsnijden en vertakkende regeneratie door in de originele 10 armen. Met als gevolg dat het aantal armen nu 20 wordt. In deze 20 nieuwe armen, herhaalt dit fenomeen zich, wat tot gevolg heeft dat een volwassen dier eindigt met 40 armen.
De individuen in het baai kweek systeem (zie uitleg beneden) worden twee jaar na de bevruchting seksueel volwassen. De tijd waarin ze volwassen worden hangt af van de bevolkingsdichtheid van de dieren. Om ze vroeg volwassen te laten worden, moet de dichtheid zo laag zijn dat ze genoeg voedsel uit het water kunnen halen.
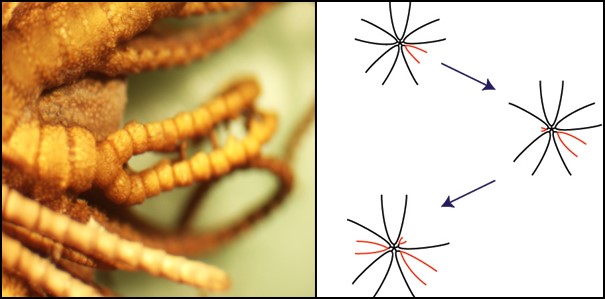
Figuur 8:Vertakkende regeneratie.
Links: plaats waar het zelf afsnijden van een originele arm en regeneratie van twee nieuwe armen optreedt. Rechts: een afbeelding van het chronologische proces van het vermeerderen van armen bij een individu.
Lange termijn kweek van bevruchting tot seksuele volwassenheid is door gebrek aan voedsel moeilijk in een aquarium, en is tot nu toe nog niet gelukt. Daarentegen, is er wel een kweeksysteem in de baai gerealiseerd. De kweekmethode die we gebruikt hebben is als volgt:
Bevruchte eieren werden in een plastic container van 30 cm diameter, met ongeveer 7000 eieren in 10 liter(ongeveer 2.6 USG) zeewater, uitgebroed (fig. 9 links). De container werd afgedekt met een plastic folie om verdampen van water en contaminatie met stof te voorkomen. Het zeewater in de kweekcontainer werd om de dag vervangen door vers gefilterd zeewater. De watertemperatuur werd (en moet ook) dicht bij de zeewatertemperatuur van de natuurlijke omgeving gehouden. Zeven dagen na de bevruchting, hechten de meeste larven zich aan de wand of de bodem van de container en veranderen in vastzittende juvenielen, cystidea genaamd.
In dit stadium mogen ze door geen enkele verstoring van de container verwijderd worden, dus werd de container naar zee verplaatst. De container werd in een net zak met mazen van 1 cm gedaan, de opening van de zak werd dichtgebonden en aan een drijvend platform, dat in de baai verankerd is, gehangen (fig. 9, rechts). De hoofdzaak is de container zo op te hangen dat de opening naar beneden is gericht. Dit voorkomt de accumulatie van sediment, wat dodelijk is voor de aangehechte juvenielen op de bodem van de container.

Figuur 9: Apparatuur voor de marine cultuur in de baai. Links: Kweek van larven in het zwem stadium in containers. Rechts: containers die in net zakken gedaan worden en in de oceaan gehangen worden.
Een groot probleem van het baai kweek systeem zijn de vastzittende bodembedekkende organismen die aan de container en het net kunnen gaan hechten. Tijdens een warm seizoen zijn er vele organismen zoals sponzen, zeepokken, anemonen, borstelwormen, mossels and zeemos, zowel in als buiten de container. Zij belemmeren het voeden van haarsterren, dus is moeten deze dieren iedere een of twee maanden verwijderd worden. Volledige verwijdering is echter ook niet gewenst, omdat nadat ze los zijn van hun stengel, de vrij levende haarsterren iets nodig hebben om zich aan vast te houden. Als we de containers schoonmaken halen we vooral manteldieren en mossels weg, maar laten schelpen van zeepokken en buizen van borstelwormen, nadat we ze gebroken hebben, zitten. In het algemeen laten we de zijkant van de containers ruw. Deze methode is oorspronkelijk ontwikkeld door Grimmer et al. (1984) en verbeterd door Shibata et al. (2008).
Uitdaging van het kweken in een gesloten systeem.
We zijn in staat haarsterren in een aquarium te houden, maar het is moeilijk ze op te laten groeien tot behoorlijke grootte. Het probleem is het gebrek aan voedsel. Zoals hierboven vermeld, voeden ze zich in hun natuurlijke omgeving met plankton en organisch materiaal. Zij schijnen zich ook vele uren per dag te voeden. In het aquarium zou het aanbieden van voldoende voedsel, leiden tot water vervuiling, dus voldoende voeding is niet eenvoudig. Ze voeden met levend voedsel als artemia’s (Artemia salina) zou een oplossing zijn. We proberen ze zoveel mogelijk te voeden met copopoden, wielvormige microscopisch kleine dieren (rotiferen zoals Brachionus plicatilis), diatomeeën en artemia. De volgende uitdaging is het kweken van haarsterren tot seksuele volwassenheid in een gesloten systeem en hun hele levenscyclus in het aquarium te observeren.

Figuur 10: Een heldergele haarster op een rif in de Filippijnen.
Huidige aquacultuur technieken staan het succesvol houden en kweken van deze unieke dieren in een gesloten systeem nog niet toe (foto: Hans Leijnse).
Alle foto’s, tenzij anders vermeld, zijn van Dr. Tomoko F. Shibata.
Referenties:
Grimmer JC, Holland ND and Kubota H, The fine structure of the stalk of the pentacrinoid larva of a feather star, Comanthus japonica ( Echinodermata, Crinoidea), Acta Zoologica, 1984, pp 41-58 (65)
Holland ND, Echinodermata: Crinoidea, in “Reproduction of Marine Invertebrates Vol 4, Echinoderms and Lophophorates”, edited by AC Giese, JS Pearse and VB Pearse, 1991, The Boxwood Press, Pacific Grove, pp247-299
Kitazawa K, Oji T and Sunamura M, Food composition of crinoids (Crinoidea: Echinodermata) in relation to stalk length and fan density: their paleoecological implications, Marine Biology, 2007, pp 959-968 (152)
Kubota H, Echinoderms (I) Comatulid, in “Developmental Experiments of Marine Inverebrates” edited by M Ishikawa and T Numakunai, 1988, Baifu-kan, Tokyo, pp 97-103 (in Japanese)
Nichols D, The histology and activities of the tube-feet of Antedon bifida, Quarterly Journal of Microscopical Science, 1960, pp105-117 (101)
Obuchi M, Kogo I and Fujita Y, A new brooding feather star of the genus Dorometra (Echinodermata: Crinoidea: Comatulida: Antedonidae) from the Ryukyu Islands, southwestern Japan, Zootaxa, 2009, pp 61-68 (2008)
Rutman J and Fishelson L, Food composition and feeding behavior of shallow-water crinoids at Eilat (Red Sea), Marine Biology, 1969, pp46-57 (3)
Shibata TF and Oji T, Autotomy and arm number increase in Oxycomanthus japonicus (Echinodermata, Crinoidea), Invertebrate Biology, 2003, pp 373-377(122)
Shibata TF, Sato A, Oji T and Akasaka K, Development and growth of the feather star Oxycomanthus japonicus to sexual maturity, Zoological Science, 2008, pp 1075-1083 (25)
















