Portaalsite voor de échte zeeaquariaan
Fosfaatbestrijding met lanthaanchloride
Klik op de tekst hieronder om het artikel te downloaden
Hoeveel zout is er in zoutwater?
Deze vraag, waarvan velen denken, dit is eenvoudig, blijkt bij nadere beschouwing spijtig genoeg verraderlijk: Hoe hoog is eigenlijk het zoutgehalte in onze aquaria?
Beschouwingen over de meting van het zoutgehalte in het zeewateraquarium.

We meten met aerometers, dichtheidsmeters met drijvende naald, geleidbaarheidsmeters of refractometers en zolang we een goede aerometer gebruiken, het drijvende naaldje zuiver houden en niet beschadigen en de geleidbaarheidsmeter en de refractometer geregeld kalibreren (ijken), kunnen we beoordelen of ons zoutgehalte constant blijft of niet. Of we kunnen zeggen hoe hoog het zoutgehalte, de dichtheid of de geleidbaarheid is, en daarmee vergelijkingen kunnen trekken met de aquaria van onze handelaars of van andere aquarianen, dat is een gans ander thema. Hieromtrent zal wat volgt duidelijkheid geven.
Mij is al meermaals opgevallen, dat bij dit thema nog enkele onduidelijkheden bestaan:
- de saliniteits-/dichtheidstabel van de Seatest-dichtheidsmeter van Aquarium Systems bestaat uit waarde-paren, de ene keer voor 14°C en die dan weer voor waarden tot 30°C gelden. Zonder constante verwijzingstemperatuur heeft zulke tabel helemaal geen zin.
- De soortgelijk opgebouwde hydrometer van Instant Ocean heeft wel een saliniteits-/dichtheidstabel met een constante verwijzingstemperatuur, maar deze ligt op 15°C, terwijl in de gebruiksaanwijzing staat dat het toestel geschikt is voor metingen tussen 20 en 29°C.
- Bij de refractometer RHS-10ATC, die zich volgens de fabrikant op 20°C baseert, is de dichtheid-/saliniteitsbeoordeling dan eens voor 9°C, soms voor 15°C, dus niet voor het opgegeven temperatuurbereik.
- Als ik bijvoorbeeld met de Seatest een dichtheid meet van 1.022, is daarvoor een saliniteit van 29,25 aangegeven. In werkelijkheid stemt deze dichtheid (bij 25°C) overeen met een zoutgehalte van 33,23. Een verschil van meer dan 10%!!
Wat is zo moeilijk in deze problematiek?
De moeilijkheden beginnen al bij de begrippen. Er wordt gesproken over dichtheid, over geijkt gewicht, soortelijk gewicht, over zoutgehalte, over saliniteit en over geleidbaarheid, en dikwijls is het niet duidelijk welk begrip wat eigenlijk aanduidt, en hoe de gemeten waarden met elkaar in verband staan.
Het soortelijk gewicht is een verouderde benaming die vroeger in de plaats van dichtheid werd gebruikt. Die eenheid wordt in de wetenschap niet meer aangewend en zou in de aquaristiek ook niet meer moeten gebruikt worden.
Dichtheid geeft het gewicht per volume aan, dus kg per liter of, wat identiek is, gram per kubieke cm. Water heeft bij 4°C exact een dichtheid van 1. De dichtheid van zout water is afhankelijk van het zoutgehalte, van de druk en van de temperatuur. De dichtheid is een absolute grootheid, termen zoals “relatieve dichtheid” zijn niet duidelijk gedefinieerd en zouden daarom best niet gebruikt worden.
Daarvan te onderscheiden is het begrip geijkt gewicht, dat voor onze doelstelling niet geschikt is omdat het zich baseert op het absolute gewicht in functie van de plaats-afhankelijke zwaartekracht.
Het geleidbaarheidsvermogen geeft aan hoe goed het water een elektrische stroom doorlaat. Ze wordt meestal aangegeven in milli-siemens per centimeter, maar kan ook in siemens per meter worden aangegeven waarbij geldt: 1 S/m = 10 mS/cm. Siemens is het tegenovergestelde van de weerstandswaarde Ohm. De geleidbaarheid is afhankelijk van het zoutgehalte en de temperatuur. Theoretisch ook van de samenstelling van het zout, maar voor aquariummetingen is dit niet relevant.
Saliniteit is een in de zee-chemie gebruikte eenheid, die de verhouding aangeeft van de geleidbaarheid van een genomen staal ten opzichte van de geleidbaarheid van een vast gedefinieerde standaardoplossing. In de aquarium praktijk kan men saliniteit gelijkstellen aan het zoutgehalte. Terwijl het zoutgehalte de eenheid gram per liter heeft, wordt de saliniteit daarentegen zonder eenheid of in promille aangegeven (saliniteit 35 = saliniteit 35 promille = zoutgehalte 35 g/l).
De saliniteit is als enige meetwaarde onafhankelijk van de temperatuur.
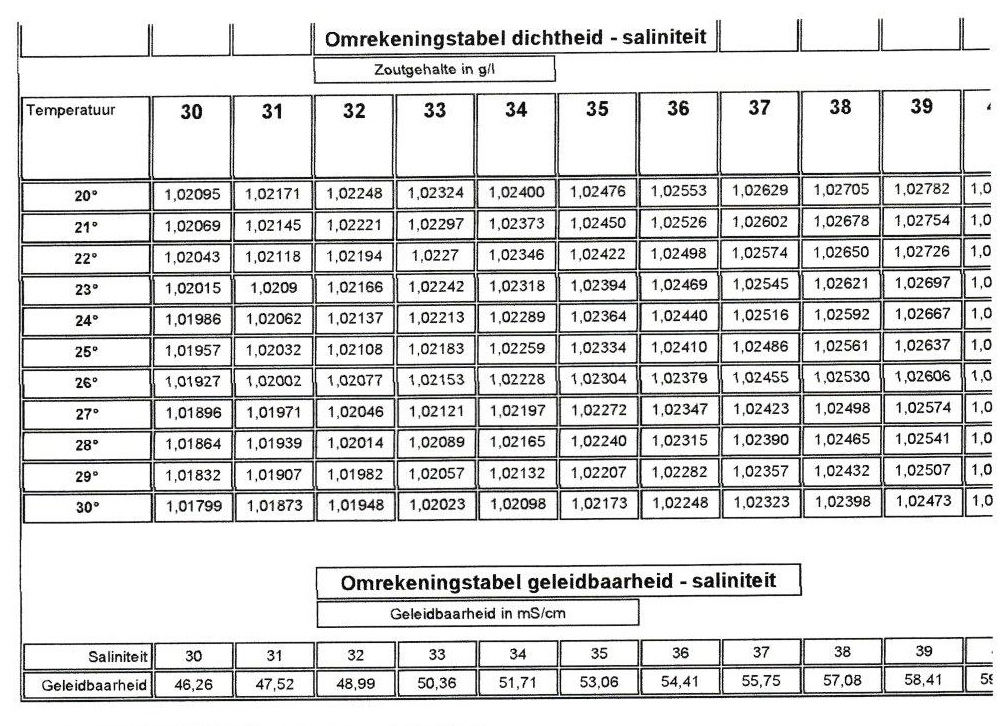
De drie gebruikt gegevens dichtheid, geleidbaarheid en saliniteit/zoutgehalte staan altijd in een verhouding tot elkaar: bij gelijke druk zal bijvoorbeeld bij 25°C en een dichtheid van 1,0234 een geleidbaarheid van 53,0 en een saliniteit van 35 gemeten worden. Dus een zoutgehalte van 35 gram per liter. Spijtig genoeg zal men niet altijd een dergelijke tabel ter beschikking hebben en zeker niet uit het hoofd kennen.
Saliniteit in verschillende oceanen (oppervlaktewater in het bereik van de riffen)
Atlantische Oceaan 36-37
Golf van Mexico 35
Golf van Guinea 31
Indische Oceaan 34-36
Stille Oceaan 34-35
Rode Zee 41
Middellandse Zee 39
Bijgevolg zou het praktisch zijn als we ons in de aquaristiek op één grootheid zouden afstemmen, zodat gegevens vergelijkbaar zijn.
Daar de dichtheid en de geleidbaarheid temperatuurafhankelijk zijn, stel ik voor, zoals het ook in de chemie gebruikelijk is, zoutgehalte/saliniteit als standaardgegeven te gebruiken. Dan kunnen we altijd en overal, zonder rekening te moeten houden met de temperatuur, onze waarden vergelijken! We moeten evenwel opletten met het feit dat het zoutgehalte zich niet laat berekenen met de hoeveelheid zout die men in een hoeveelheid water doet. Dat komt omdat het volume door de toevoeging van het zout verandert, en dat de zoutmengeling ook water opneemt. Als ik 35 gram zeezout in een liter water doe, ligt het zoutgehalte onder de 35 gram per liter.
De meetmethodes.
We moeten de saliniteit natuurlijk ook meten. Daarvoor hebben we de volgende mogelijkheden:
De aerometer.
Hiermee wordt de dichtheid vastgesteld. Men moet bijgevolg ook altijd de temperatuur meten vooraleer men een oordeel kan geven. Aerometers zijn normalerwijze niet temperatuur-compenserend. De meting is bijgevolg enkel maar bij één bepaalde temperatuur exact. Die temperatuur is op de aerometer aangegeven en bedraagt meestal 25°C. Dikwijls is er ook een tweede temperatuur aangegeven. Deze betekent dat de gemeten dichtheid zich relateert ten opzichte van de dichtheid van zuiver water gemeten op deze tweede temperatuur. Bedraagt deze tweede temperatuur 4°C (vermeld op de aerometer 4°/25°C), dan krijgt men de correcte dichtheid, vermits water bij 4°C de exacte dichtheid 1,0 heeft. Als de aquariumtemperatuur echter geen 25°C bedraagt, dan meet men een verkeerde, namelijk te hoge dichtheid.. Bij een ijkingstemperatuur van 25°C (op de aerometer staat dan 25°C/25°C) meet men voor een echte waarde van 1,023 de waarde 1,026. Houdt men geen rekening met deze foute dichtheidsmeting, dan krijgt men in plaats van de juiste saliniteit van 34,5 een waarde van 38,5! Om de juiste waarden te bekomen, moet men in dit voorbeeld de gemeten waarde bij 25°C vermenigvuldigd worden met 0,997. Zulke aerometers zijn voor ons doel eigenlijk ongeschikt. Ze zijn echter nog in gebruik en stichten veel verwarring.
Hoe langer de spil (het smalle gedeelte van het apparaat), hoe groter de schaal is, hoe exacter we kunnen aflezen. Let er op dat de aerometer langs onder dient te worden afgelezen, omdat de juiste waarde precies op de hoogte zit van de waterspiegel en niet op de hoogte van het gebogen wateroppervlak dat zich optrekt aan de spil. Met wat routine kunnen we natuurlijk ook uit de waarde, die men langs boven afleest, de echte waarde afleiden. Als de aerometer zuiver en onbeschadigd is, kunnen we zeer precieze waarden meten en aan de hand van de tabel hieronder, dadelijk de bijbehorende saliniteit aflezen.
De geleidbaarheidsmeter.
Een zeer snelle en doeltreffende mogelijkheid om de geleidbaarheid en daarbij aan de hand van een tabel de saliniteit te meten. Met de geleidbaarheidsmeter kunnen we snelle en nauwkeurige metingen doorvoeren, omdat geringe saliniteitsverschillen al duidelijke verschillende meetwaarden afleveren. Door de ingebouwde temperatuurcompensatie heeft men altijd waarden die overeenstemmen met 25°C. Maar verwarrend is dat vele geleidbaarheidsmeters in plaats van de geleidbaarheid dadelijk de dichtheid aangeven maar veel beter zijn apparaten die dadelijk de saliniteit aangeven. De meest gebruikte apparaten moeten, zoals de Ph-meter, geregeld met een standaardoplossing gekalibreerd worden.
Nadeel van deze apparaten is de prijs. Je kunt er van € 320 kopen, maar ook van € 12. De duurdere toestellen moeten doorgaans niet gekalibreerd worden.
Je kunt er echter ook meer dan €1.000 aan uitgeven. Let er op dat het meetbereik tot en met 60 milli-siemens (niet micro-siemens!) gaat.

De refractometer
Deze gelden net als de “state of the art” in de aquaristiek en bieden de aanlokkelijke mogelijkheid, om met enkele druppels water snel een vrij nauwkeurige saliniteitsmeting uit te voeren. Spijtig genoeg hebben ook deze kleine kunstwerken hun eigenaardigheden. Het begint al met de dichtheidsschaal die bij de RHS-10ATC volledige onzin aangeeft. Dit is echter niet zo tragisch, omdat er ook een saliniteitsschaal beschikbaar is. In het geval van de RHS-10ATC is er echter een ander ernstig probleem. Op de schaal staat “Salinity” en het apparaat werd me ook verkocht als refractometer voor zeewater. Ik heb namelijk vastgesteld door vele metingen dat het apparaat is ontworpen voor zuivere natriumchloride oplossingen, dus keukenzout! Daardoor krijgt men tussen 30 en 40 g/l een lineaire fout van +2. Men moet dus altijd van de gemeten saliniteit 2 punten aftrekken om de juiste waarde te verkrijgen! Omdat de saliniteitsschaal gaat van 0 tot 100 promille (= 0 – 100 gram zout/l) is de afleesnauwkeurigheid niet erg duidelijk en is het niet eenvoudig om 34 van 35g/l te onderscheiden. Beter zouden er refractometers bestaan die met een kleiner saliniteitsbereik konden functioneren. Hoe kleiner het bereik hoe gemakkelijker de afleesnauwkeurigheid.
De pipet waarmee het waterstaal wordt genomen, mag geen zoutresten bevatten van de vorige meting, omdat wegens de kleine waterhoeveelheid het geringste extra zout de meting zal vervalsen. Dus na iedere meting de pipet met zoetwater spoelen! Ook hier geldt dat de metingen correct zullen zijn als het apparaat regelmatig wordt gekalibreerd.


In het maart 2014-magazine van ReefSecrets staat op pagina 15 een bijdrage: “Wat we moeten weten over de refractometer” door Fred ten Hove. Hierin worden twee fouten beschreven waar we ons vaak aan bezondigen. Omdat het zo belangrijk is dat die fouten niet meer gemaakt worden herneem ik hier even een passage uit dit artikel:
Fout 1
Volgens de gebruiksaanwijzing moet de refractometer voor we hem kunnen gebruiken, eerst geijkt worden. Het ijken doen we volgens de gebruiksaanwijzing met een paar druppels gedestilleerd water. Vervolgens stellen we met het kalibratieschroefje de breking van het licht zodanig af dat de overgang blauw/wit precies op de 0-lijn valt. Helemaal juist, maar we gaan de refractometer gebruiken voor het meten van zeewater en niet voor een keukenzoutoplossing. Wie wel eens op een emmer of pak zout heeft gekeken heeft ongetwijfeld gezien dat er nog veel meer zouten dan alleen NaCl (in de volksmond:- keukenzout) in de emmer zit. Al deze zouten hebben invloed op de meting met de refractometer die we gaan doen en zorgen voor een verkeerde uitlezing als we de refractometer eerst keurig netjes met gedestilleerd water op 0 hebben geijkt. Het op juiste wijze ijken van de refractometer De refractometer ijken we niet met gedestilleerd water zoals in de gebruiksaanwijzing staat, maar met een referentievloeistof die zo dicht mogelijk in de buurt komt van wat we willen meten. Voor ons is dit natuurlijk zeewater. Zeewater waarbij vooraf in een laboratorium de exacte saliniteit is bepaald, dan wel is samengesteld. Het klinkt moeilijker dan het daadwerkelijk is want deze referentievloeistof is kant en klaar in de winkel te koop. Er zijn verschillende merken, maar de meest bekende is denk ik toch wel de “Refracto-Check” van Salifert. De saliniteit van deze vloeistof is exact 35‰. Druppel een paar druppels van deze referentievloeistof op het prisma en stel met het kalibratieschroefje de breking van het licht zodanig af dat de overgang blauw/wit precies op de lijn 35‰ valt. De refractometer is nu op de juiste wijze geijkt.
Doen we hierna een testje met gedestilleerd water dan valt direct op dat de overgang blauw/wit ongeveer 2‰ onder de 0-lijn valt. Kortom: goed geijkt geeft de refractometer nu ongeveer 2‰ minder aan, fout geijkt ongeveer 2‰ teveel. Heeft u in het verleden met gedestilleerd water geijkt, dan is het water in uw aquarium nu waarschijnlijk te zout.
Fout 2
Soortelijk gewicht of saliniteit? Het is u misschien al opgevallen dat ik het steeds over saliniteit heb en niet over soortelijk gewicht en/of dichtheid. Deze eenheden worden namelijk niet meer gebruikt. Als we over het zoutgehalte van ons aquariumwater praten dan bedoelen we dus eigenlijk de saliniteit. Met een zoutgehalte of saliniteit van 35 bedoelen we 35‰ (promille) ofwel 35 gram per liter. Dit is dimensieloos en ook onafhankelijk van temperatuur. Een kilo is een kilo, een liter is niet altijd een kilo. De dichtheid (soortelijk gewicht, specific gravity) is in g/liter en dus wel temperatuur afhankelijk. Veel zeeaquarianen praten nog over het soortelijk gewicht of dichtheid van zeewater en zijn al snel geneigd om de linker schaal van de refractometer te gebruiken. Bij deze schaal staat dan ook SG (soortelijk gewicht). Zoals eerder gezegd is deze eenheid temperatuurafhankelijk. Ik hoor u al denken, want uw refractometer heeft natuurlijk een automatische temperatuur correctie (ATC) van + en - 10°C. U heeft helemaal gelijk hoor. Volgens mij hebben ze dit tegenwoordig allemaal. Maar heeft u al goed gekeken? Op de SG schaal staat toch echt 20°C. Met andere woorden de automatische temperatuur correctie, corrigeert een temperatuur tussen de 10°C en 30°C automatisch naar 20°C. Dit is natuurlijk niet correct want wat wij willen weten is de dichtheid of het soortelijk gewicht bij 25°C. Hoe kouder het water, des te hoger het soortelijk gewicht of dichtheid. Dit is ook duidelijk te zien als we een denkbeeldige lijn tussen de linker- en rechterschaal trekken. Bij een saliniteit van 35‰ komen we uit op een soortelijk gewicht van 1,026. In werkelijkheid moet dit dus 1,0234 bij 25°C zijn. Wederom een behoorlijke afwijking! De linker schaal (SG) is dus absoluut niet bruikbaar voor het meten van ons zeewater.
Bij het aflezen van het zoutgehalte (saliniteit) gebruiken we dus alleen de rechterschaal waar ‰ en/of PPT (parts per thousand) bijstaat. De saliniteit van natuurlijk zeewater ligt tussen de 33 en 35‰ en dit zijn dan ook de waarden die we nastreven in ons aquarium. Wie wat verder van de chemie afstaat en het allemaal wat te “technisch” vindt, hoeft eigenlijk alleen het volgende te onthouden: IJk de refractometer met een referentievloeistof, bij voorkeur met een referentievloeistof waarvan de saliniteit 35‰ bedraagt. Maak eerst het prisma goed schoon, druppel een paar druppeltjes referentievloeistof op het prisma, sluit het klepje en draai met een klein schroevendraaiertje aan het kalibratieschroefje tot de refractometer exact de waarde van de referentievloeistof aangeeft. Gebruik alleen de rechterschaal waar ‰ en/of PPT staat. De linker schaal niet gebruiken. Streef in het aquarium naar een saliniteit tussen de 33 en 35‰.
Nog enkele tips:
- De refractometer is een precisie-instrument, ga er dus voorzichtig mee om.
- Controleer voor het gebruik altijd eerst met een referentievloeistof of de waarde nog klopt. Indien nodig opnieuw ijken.
- De eerste druppel(s) van de referentievloeistof niet gebruiken. Deze kan opgedroogde zoutresten bevatten.
- Na het sluiten van het klepje moet het water zich zonder luchtbellen of droge plaatsen verdelen over het gehele oppervlak van het prisma.
- Maak na afloop het prisma en het transparante klepje goed schoon met een zacht doekje en een beetje water.
- De refractometer niet onderdompelen of onder de kraan afspoelen.
- Het bijgeleverde pipetje niet gebruiken. Als er zoutresten van de vorige meting zijn achtergebleven, klopt de meeting niet meer. Zo ook natuurlijk met zoetwater.
- Is de uitlezing, overgang blauw/wit of de schaalverdeling niet scherp afleesbaar, stel deze dan scherp door aan het oculair te draaien.
Saliniteitsmeters met drijvende naald
Deze toestelletjes zijn prijsgunstig en gemakkelijk in het gebruik. Afgezien van de verwarde dichtheidsaanwijzingen, die we eenvoudig als onnuttige versiering aanzien, leveren ze goede saliniteitswaarden. Bij deze apparaten stel ik dringend voor, om bij het eerste gebruik, de gemeten waarde te vergelijken met één van de andere toestellen, om uit te maken welke de exacte saliniteit is die de gemeten waarde aanduidt. Bij de meting moet er op gelet worden dat er geen luchtbelletjes aan de drijvende naald hangen. Deze zullen een hogere meting geven. Ook na gebruik met zoetwater uitspoelen, zodat er geen zoutafzetting op de naald blijft zitten die het zoutgehalte bij de volgende meting zal doen toenemen.
Besluit.
Voor de routinecontroles van het zoutgehalte zijn alle genoemde apparaten geschikt. Als men let op de vermelde kuren van de toestellen, dan blijft men uiteindelijk met de vraag welke meter krijgt mijn voorkeur om ervaringen te kunnen uitruilen met andere aquarianen is het echter absoluut noodzakelijk een correcte omrekeningstabel, zoals deze in dit artikel, te gebruiken. We moeten ons daarenboven de temperatuurs-onafhankelijke waarde “saliniteit” eigen maken om meetwaarden uit te drukken. Dan hebben we de beste voorwaarden om verschillende aquaria met elkaar te vergelijken.
Bronnen:
Glaser Armin: Der meerwasser Aquarianer 1/2004
ten Hove Fred: Wat we moeten weten over de refractometer, www.reefsecrets.org 1/2014
Cruciale waterparameters zijn afhankelijk van de saliniteit
De laatste jaren worden steeds meer parameters gemeten in onze rifaquaria. Waar we ons vroeger beperkten tot saliniteit, Ph, kH, nitraat, fosfaat, magnesium en calcium zijn we thans in staat om veel meer sporenelementen te meten die belang hebben in de gezondheid van onze vissen en koralen.
Op de website van aquaforest kwam ik de volgende post tegen:
De saliniteit is een van de belangrijkste waterparameters in een zoutwater aquarium. In feite is het de maatstaf van natrium-ionen opgelost in water. Typisch wordt het gemeten in ppt - delen per duizend - en hoe meer zout in je water, hoe hoger alle andere waterparameters zullen zijn.
Meestal houden hobbyisten de saliniteit op 32-33 ppt, maar tijdens jaren van onze rifervaring hebben we aquaristen ontmoet met 28 tot zelfs 40 ppt. Wat is daar de reden voor? Als de belangrijkste factor van de toestand van je koralen zou het regelmatig gemeten moeten worden, maar waarschijnlijk wordt het vaak over het hoofd gezien. Andere mogelijkheid is dat aquaristen niet goed weten te meten. Het komt voor dat refractometers die zijn toegewijd aan de voedingsindustrie, worden gebruikt om zeewater te controleren. Het is een veel voorkomende fout, die kan leiden tot grote meetfouten.
Verdampen van water kan de reden zijn van saliniteitsschommelingen in je aquarium. Vooral in nano-aquaria kan zelfs de kleine hoeveelheid verdampt water leiden tot een significante saliniteitssprong. Een automatisch bijvulsysteem kan je helpen om deze problemen op te lossen en je aquarium te redden van dagelijkse schommelingen. Nog een fout in het behouden van stabiele parameters is het oplossen van het zout direct in het aquarium. Dat moet je nooit doen, zelfs als je van plan bent om zout in een hoogstroomgebied van de sump te plaatsen. Je zult niet kunnen controleren, als alles goed opgelost is en ten tweede, zoutkristallen kunnen het delicate weefsel van je koralen of vis verbranden.
Het is zeer eenvoudig, hoe meer zout je gebruikt, hoe meer elementen je aan het water levert en al hun niveaus verhogen samen met de saliniteit. Daarom moet je het over elementsniveaus hebben, je moet ze altijd analyseren met betrekking tot het zoutgehalte. We hebben wat grondige testen gedaan om je te laten zien hoe het precies invloed heeft op het niveau van chemische elementen. De resultaten zijn overtuigend. Elk parameterniveau verandert afhankelijk van de hoeveelheid gebruikt zout. Waarom is het cruciaal voor je aquarium? Omdat noch overdaad noch tekortkomingen aan elementen gezond zijn voor de inwoners van je aquarium.

Om de test goed uit te voeren, gebruikten we twee perfect geijkte ICP-OES spectrometers en geanalyseerde gegevens van mariene watermonsters met een zoutgehalte van 30 tot 40 ppt. Deze methode heeft ons geholpen om betrouwbare gegevens te verzamelen en te verifiëren. Waarom hebben we dit gedaan? Het gebeurt dat je ons vraagt naar verschillende parameters aanbevolen waarden zonder het zoutgehalte te noemen. Dit is waarom wij denken dat het de sleutel is om de andere parameters binnen bereik te houden.
Bron: https://m.facebook.com/Aquaforest/?__tn__=%2Cg
Noot van de redactie:
Als je dus spreekt over je waterparameters, vermeld dan ook steeds de saliniteit. Je kunt aan de hand van nevenstaande tabel omrekenen hoeveel je van een parameter moet hebben bij een ander zoutgehalte. Ook de temperatuur van het water speelt een rol. Hoe hoger de temperatuur, hoe meer volume het water inneemt. Maar omdat het water in onze rifaquaria constant 24 à 25 °C is, werd met de temperatuurparameter blijkbaar geen rekening gehouden.
Optimale parameters voor een rifaquarium
Door Randy Holmes-Farley - Vertaling en bewerking: Germain Leys
Een van de belangrijkste taken van een aquariumliefhebber met een koraalrifaquarium is ervoor te zorgen dat de omstandigheden geschikt zijn voor hun aquariumbewoners. Er zijn veel verschillende kenmerken van het aquarium die moeten worden gecontroleerd, waaronder verlichting, waterstroming, temperatuur en de concentraties van de vele chemicaliën in het water. Dit artikel richt zich op problemen met de waterchemie en toont mijn aanbevelingen voor de belangrijkste van de verschillende chemische parameters in een rifaquarium.
Tabel 1 toont een samenvatting van enkele van de belangrijkste waterparameters voor rifaquaria. Tabel 2 toont enkele van de minder kritische parameters, of die parameters die voor veel aquariumliefhebbers te ingewikkeld zijn om zorgvuldig te controleren, maar waarover veel aquariumliefhebbers zich zorgen maken of vragen over hebben. De rest van dit artikel geeft de rationele en verdere bespreking van elk van de parameters in deze tabellen.
Een gedetailleerde bespreking van een individuele parameter zou een heel artikel kunnen vullen, en daarom wordt het commentaar hier noodzakelijkerwijs afgekort.
Tabel 1. Parameters die essentieel zijn voor controle in rifaquaria.
|
Parameter: |
Rif aquarium aanbeveling |
Waarde in oppervlaktewater in de oceaan: |
|
Calcium |
380-450 ppm |
420 ppm |
|
Alkaliniteit |
7-11 dKH (behalve zeer arme systemen) |
7 dKH 2,5 meg/liter |
|
saliniteit |
35 ppt |
34-36 ppt |
|
temperatuur |
24-28 °C |
variabel |
|
pH |
7,8-8,5 is oké |
8,0-8,3 (kan hoger of lager zijn in lagunes) |
|
Magnesium |
1.250-1.350 |
1.280 ppm |
|
Fosfaat |
<0,03 ppm |
0,0005 ppm |
|
Ammoniak |
<0,1 ppm |
Variabel (gewoonlijk < 0,1) |
Tabel 2. Andere parameters in rifaquaria die aquariumliefhebbers mogelijk willen controleren.
|
Parameter: |
Rif aquarium aanbeveling |
Waarde in oppervlaktewater in de oceaan: |
|
Kalium |
380-420 ppm |
400 ppm |
|
Silicium |
< 2 ppm, veel lager indien diatomeeën een probleem vormen |
< 0,06-2,7 ppm |
|
Jodium |
0,03 ppm jodium (*) |
0,03 ppm jodium; 0,06 ppm totaal van alle jodium-vormen |
|
Nitraat |
< 0,2 ppm |
variabel (gewoonlijk lager dan 0,1 ppm) |
|
Nitriet |
< 0,2 ppm |
variabel, gewoonlijk lager dan 0,0001 ppm |
|
Strontium |
5-15 ppm (*) |
8 ppm |
|
Redox |
controle niet aanbevolen |
variabel |
|
Borium |
< 10 ppm (*) |
4,4 ppm |
|
Ijzer |
met gewone testen niet detecteerbaar (toevoegingen zijn oké) |
1,6 ppm |
(*) Ik raad over het algemeen niet aan om deze parameters te meten en te controleren, maar als je dat wel doet, zijn dit de richtlijnen.
Sommige aquariumliefhebbers zijn zich meer gaan concentreren op het meten van sporenelementen (dit wil zeggen die aanwezig zijn in zeer lage niveaus, zoals ijzer of koper). Met uitzondering van ijzer, dat een lange geschiedenis heeft van nut bij het doseren, zal ik op deze andere sporenelementen op dit moment niet ingaan, omdat de methoden om ze te meten en te controleren niet zo eenvoudig zijn als de andere ionen in dit artikel.
Kritische parameters
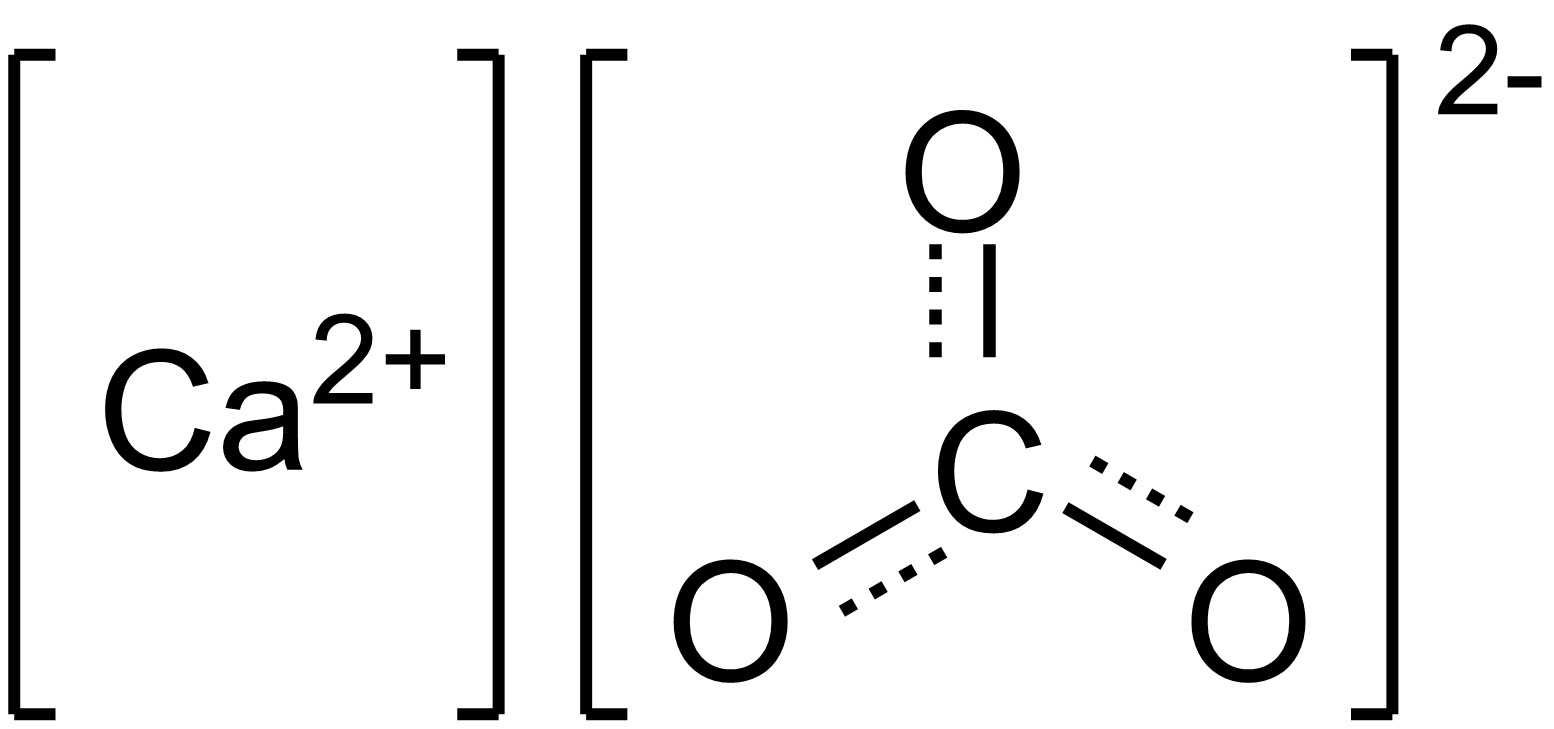
Calcium
Veel koralen gebruiken calcium om hun skelet te vormen, dat voornamelijk bestaat uit calciumcarbonaat. De koralen halen het meeste calcium voor dit proces uit het omringende water. Bijgevolg raakt calcium vaak uitgeput in aquaria met snelgroeiende koralen, kalkhoudende roodalgen (koraalalgen), Tridacnids (mosselen) en Halimeda (een macroalg die calciumcarbonaat bevat). Naarmate het calciumgehalte daalt tot onder 360 ppm, wordt het voor deze organismen steeds moeilijker om voldoende calcium te verzamelen, waardoor hun groei wordt belemmerd.
Het op peil houden van het calciumgehalte is een van de belangrijkste aspecten van het kweken van koraalriffen. De meeste rifaquariumliefhebbers proberen een ongeveer natuurlijk calciumgehalte in hun aquarium te behouden (circa 420 ppm). Het lijkt er niet op dat het verhogen van de calciumconcentratie boven het natuurlijke niveau de verkalking (dit wil zeggen de groei van het skelet) in de meeste koralen bevordert.

Het element calcium, bewaard in een afgesloten argon-atmosfeer omdat het in de lucht dadelijk oxideert. Foto: Wikimedia commons
Om deze redenen stel ik voor dat aquariumliefhebbers een calciumgehalte tussen ongeveer 380 en 450 ppm handhaven, hoewel hoger over het algemeen geen probleem is totdat het zo hoog wordt dat de neerslag van calciumcarbonaat problematisch wordt. Aquariumliefhebbers met een geringe afwijking kunnen calcium mogelijk op peil houden door water te verversen, vooral omdat sommige zoutmengsels overmatig calcium bevatten. Maar de meeste gevestigde aquaria met groeiende harde koralen en kalkalgen zullen enige calciumtoevoeging nodig hebben, en in sommige gevallen kan het elke dag nodig zijn.
Ik raad meestal aan om voor het routine-onderhoud een uitgebalanceerd calcium- en alkaliteitsbijvulsysteem te gebruiken. De meest populaire van deze uitgebalanceerde methoden zijn kalkwater, calciumcarbonaat/kooldioxide-reactoren en de twee- of driedelige additieve systemen voor calcium en alkaliteit. Als de calcium echter op is en aanzienlijk moet worden verhoogd, zijn dergelijke uitgebalanceerde methoden geen goede keuze, omdat ze de alkaliteit te veel verhogen. In dat geval is het toevoegen van calciumchloride een goede methode om in een eenmalige correctie calcium te verhogen.
Alkaliteit
Net als calcium gebruiken veel koralen ook “alkaliteit” om hun skeletten te vormen, die voornamelijk uit calciumcarbonaat bestaan. Algemeen wordt aangenomen dat koralen bicarbonaat opnemen, het omzetten in carbonaat en dat carbonaat vervolgens gebruiken om calciumcarbonaatskeletten te vormen. Dat omzettingsproces wordt weergegeven als:
HCO3- → CO32- + H+
Bicarbonaat → Carbonaat + proton (dat vrijkomt uit het koraal)
Om ervoor te zorgen dat koralen voldoende bicarbonaat voor verkalking hebben, kunnen aquariumliefhebbers gewoon direct bicarbonaat meten. Het ontwerpen van een testkit voor bicarbonaat is echter iets gecompliceerder dan voor alkaliteit. Bijgevolg is het gebruik van alkaliteit als surrogaatmaat voor bicarbonaat diep verankerd in de hobby van het rifaquarium.
Dus, wat is alkaliteit? Alkaliteit in een zeeaquarium is gewoon een maat voor de hoeveelheid zuur (H+) die nodig is om de pH te verlagen tot ongeveer 4,5, waarbij alle bicarbonaat als volgt wordt omgezet in koolzuur:
HCO3- + H+ → H2CO3
De benodigde hoeveelheid zuur is gelijk aan de aanwezige hoeveelheid bicarbonaat, dus bij het uitvoeren van een alkaliteittitratie met een testkit, ‘telt’ u het aantal aanwezige bicarbonaationen. Zo eenvoudig is het echter niet, omdat bij de titratie ook andere ionen zuur opnemen. Zowel boraat als carbonaat dragen ook bij aan de meting van de alkaliteit, maar het bicarbonaat domineert deze andere ionen omdat ze over het algemeen een lagere concentratie hebben dan bicarbonaat. Dus het kennen van de totale alkaliteit is verwant aan, maar niet precies hetzelfde als, weten hoeveel bicarbonaat beschikbaar is voor koralen. In ieder geval is totale alkaliteit de standaard die aquariumliefhebbers hiervoor hanteren.

De Hanna alkaliteit meter
In tegenstelling tot de calciumconcentratie wordt algemeen aangenomen dat bepaalde organismen sneller verkalken bij alkaliteitsniveaus die hoger zijn dan die in normaal zeewater. Dit resultaat is ook aangetoond in de wetenschappelijke literatuur, die heeft aangetoond dat het toevoegen van bicarbonaat aan zeewater de snelheid van verkalking in sommige koralen verhoogt. De opname van bicarbonaat kan bijgevolg in veel koralen snelheidsbeperkend worden. Dit kan deels komen doordat de externe bicarbonaatconcentratie om te beginnen niet groot is (ten opzichte van bijvoorbeeld de calciumconcentratie, die in feite zo’n 5 keer hoger is).
Om deze redenen is het onderhoud van de alkaliteit een cruciaal aspect van de kweek van koraalrifaquaria. Bij afwezigheid van toevoeging zal de alkaliteit snel dalen, aangezien koralen veel van wat in zeewater aanwezig is, opgebruiken.
Waterverversingen zijn meestal niet voldoende om de alkaliteit te behouden.
Tenzij er zeer weinig verkalking plaatsvindt. De meeste rifaquariumliefhebbers proberen de alkaliteit op een niveau te houden dat gelijk is aan of iets boven dat van normaal zeewater, hoewel het exacte niveau van verschillende aquariumliefhebbers een beetje afhangt van de doelen van hun aquaria.
Interessant is dat, omdat sommige koralen sneller verkalken bij hogere alkaliteitsniveaus, en omdat de abiotische (niet-biologische) neerslag van calciumcarbonaat op verwarmingstoestellen en pompen ook stijgt naarmate de alkaliteit stijgt, de vraag naar alkaliteit (en calcium) stijgt naarmate de alkaliteit stijgt.
Dus een aquariumliefhebber moet over het algemeen ELKE DAG meer calcium en alkaliteit doseren om een hogere alkaliteit te behouden (zeg 11 dKH) dan om 7 dKH te behouden. Het is niet zomaar een eenmalige boost die nodig is om dat verschil goed te maken. In feite wordt de verkalking zo langzaam als de alkaliteit onder de 6 dKH daalt, dat rifaquaria zelden veel onder dat punt komen, zelfs zonder dosering: natuurlijke verkalking is bijna gestopt op dat niveau.
In het algemeen stel ik voor dat aquariumliefhebbers de alkaliteit tussen ongeveer 7 en 11 dKH (2,5 en 4 meq/L; 125-200 ppm CaCO3-equivalenten) handhaven. Veel aquariumliefhebbers die SPS-koralen kweken en Ultra Low Nutrient Systems (ULNS) gebruiken, hebben ontdekt dat de koralen last hebben van “verbrande tippen” als de alkaliteit te hoog is of te veel verandert. Het is helemaal niet duidelijk waarom dit het geval is, maar dergelijke aquaria zijn beter gediend met alkaliteit in het bereik van 7-8 dKH.
Zoals hierboven vermeld, verhogen alkaliteitsniveaus boven die in natuurlijk zeewater de abiotische neerslag van calciumcarbonaat op warme objecten zoals verwarmingen en pompwaaiers, of soms zelfs in zandbedden. Deze neerslag verspilt niet alleen calcium en alkaliteit die aquariumliefhebbers zorgvuldig toevoegen, maar het verhoogt ook de onderhoudsvereisten van de apparatuur en kan een zandbed ‘beschadigen’, waardoor het verhardt tot een brok kalksteen. Wanneer een verhoogde alkaliteit deze neerslag aanstuurt, kan dit ook het calciumgehalte verlagen. Een te hoge alkaliteit kan daarom ongewenste gevolgen hebben.
Ik stel voor dat aquariumliefhebbers een uitgebalanceerd calcium- en alkaliteitstoevoegingssysteem gebruiken voor routine-onderhoud. De meest populaire van deze uitgebalanceerde methoden zijn kalkwater, calciumcarbonaat/kooldioxide-reactoren en de tweedelige/driedelige toevoegingssystemen.
Voor snelle correcties van de alkaliteit kunnen aquariumliefhebbers eenvoudig zuiveringszout (natriumbicarbonaat) of soda (natriumcarbonaat) gebruiken met een goed resultaat. De laatste verhoogt zowel de pH als de alkaliteit, terwijl de eerste een zeer klein pH-verlagend effect heeft. Mengsels kunnen ook worden gebruikt, en zijn wat veel toeleveringsbedrijven voor hobbychemicaliën verkopen als buffers. Meestal heeft natriumcarbonaat echter de voorkeur, omdat de meeste aquariums kunnen worden geholpen door een pH-verhoging.
Zoutgehalte
Er zijn verschillende manieren om het zoutgehalte te meten en te rapporteren, waaronder geleidbaarheidssondes, refractometers en hydrometers. Ze rapporteren meestal waarden voor soortelijk gewicht (dat geen eenheden heeft) of zoutgehalte (in eenheden van ppt of delen per duizend, ongeveer overeenkomend met het aantal gram droog zout in 1 kg water), hoewel geleidbaarheid (in eenheden van mS /cm, milliSiemens per centimeter) ook soms wordt gebruikt.
Enigszins verrassend gebruiken aquariumliefhebbers niet altijd eenheden die van nature volgen uit hun meettechniek (soortelijk gewicht voor hydrometers, brekingsindex voor refractometers en geleidbaarheid voor geleidbaarheidssondes), maar gebruiken ze de eenheden eerder door elkaar.
Ter referentie: natuurlijk oceaanwater heeft een gemiddeld zoutgehalte van ongeveer 35 ppt, wat overeenkomt met een soortelijk gewicht van ongeveer 1,0264 en een geleidbaarheid van 53 mS/cm. Het varieert vaak van 34-36 ppt over riffen, maar kan om verschillende redenen lokaal hoger of lager zijn, zoals land dat van zoet water afvloeit of verdamping uit een lagune.

Zeezout
Voor zover ik weet, is er weinig echt bewijs dat het de voorkeur verdient om een koraalrifaquarium op een ander dan natuurlijk niveau te houden. Het blijkt gebruikelijk te zijn om zeevissen, en in veel gevallen rifaquaria, iets lager te houden dan het natuurlijke zoutgehalte.
Deze praktijk komt, althans gedeeltelijk, voort uit de overtuiging dat vissen minder gestrest zijn bij een verminderd zoutgehalte. Ik heb geen idee of dat waar is of niet, maar ik heb geen bewijs gezien dat het waar is. Er zijn in het verleden ook aanzienlijke misverstanden ontstaan onder aquariumliefhebbers over hoe soortelijk gewicht zich werkelijk verhoudt tot zoutgehalte en dichtheid, vooral gezien de temperatuureffecten.
De dichtheid van zeewater is bijvoorbeeld kleiner dan het soortelijk gewicht, en metingen met glazen hydrometers kunnen temperatuurcorrectie vereisen, maar nieuwere apparaten hebben de aquariumliefhebber niet nodig om correcties aan te brengen.
Mijn aanbeveling is om het zoutgehalte op een natuurlijk niveau te houden. Als de organismen in het aquarium afkomstig zijn uit brakke omgevingen met een lager zoutgehalte, of uit de Rode Zee met een hoger zoutgehalte, kan het verstandig zijn om iets anders dan 35 ppt te kiezen. Anders stel ik voor een doelzoutgehalte van 35 ppt te gebruiken (soortelijk gewicht = 1,0264; geleidbaarheid = 53 mS/cm).
Temperatuur
Temperatuur heeft op verschillende manieren invloed op rifaquariumbewoners. Eerst en vooral stijgt de stofwisseling van de dieren naarmate de temperatuur stijgt. Ze kunnen bijgevolg meer zuurstof, koolstofdioxide, voedingsstoffen, calcium en alkaliteit gebruiken of produceren bij hogere temperaturen. Deze hogere stofwisseling kan ook hun groeisnelheid en afvalproductie bij hogere temperaturen verhogen.
Een andere belangrijke invloed van temperatuur is op de chemische aspecten van het aquarium. De oplosbaarheid van opgeloste gassen zoals zuurstof en kooldioxide verandert bijvoorbeeld met de temperatuur. Met name zuurstof kan een punt van zorg zijn omdat het bij hogere temperatuur minder oplosbaar is.
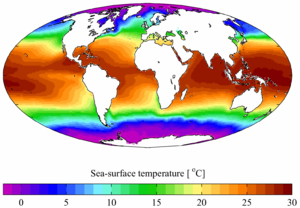
Gemiddelde zeewateroppervlakte-temperatuur. Bron: Wikipedia
Dus wat betekent dit voor aquariumliefhebbers?
In de meeste gevallen is het een waardig doel om te proberen de natuurlijke omgeving in een rifaquarium te evenaren. Temperatuur kan echter een parameter zijn die rekening moet houden met de praktische overwegingen van een klein gesloten systeem dat een stroomstoring zou kunnen ondergaan en de organismen zou kunnen vangen in een kleine hoeveelheid slecht belucht water, iets dat zelden gebeurt op een natuurlijk rif. Kijken naar de oceaan als richtlijn voor het instellen van temperaturen in rifaquaria kan ook complicaties opleveren, omdat koralen goed groeien in zo’n breed temperatuurbereik. De grootste verscheidenheid aan koralen wordt echter gevonden in water met een gemiddelde temperatuur van ongeveer 28 tot 30°C.
Tijdens de normale werking van een rifaquarium zijn het zuurstofgehalte en de stofwisseling van de aquariumbewoners niet vaak belangrijke zaken, en veel rifaquaria doen het goed met temperaturen tussen de 24 en 26°C. Tijdens een crisis, zoals een stroomstoring, kan de opgeloste zuurstof echter snel worden opgebruikt. Lagere temperaturen zorgen niet alleen voor een hoger zuurstofniveau voor een noodgeval, maar vertragen ook het verbruik van die zuurstof door het metabolisme van de aquariumbewoners te vertragen. De productie van ammoniak als organismen beginnen te sterven, kan ook langzamer zijn bij lagere temperaturen. Om dergelijke redenen kan men ervoor kiezen om een praktisch evenwicht te vinden tussen temperaturen die te hoog zijn (zelfs als koralen normaal gesproken gedijen in de oceaan bij die temperaturen), en deze die in feite te laag zijn.
Deze natuurlijke richtlijnen laten een vrij breed scala aan acceptabele temperaturen achter. Ik houd mijn aquarium het hele jaar door op ongeveer 26 tot 27°C. Ik ben eigenlijk meer geneigd om het aquarium in de zomer koeler te houden, wanneer een stroomstoring het aquarium hoogstwaarschijnlijk zou verwarmen, en hoger in de winter, wanneer een stroomstoring het waarschijnlijk zou koelen. Alles bij elkaar genomen raad ik temperaturen aan in het bereik van 24 tot 28°C, tenzij er een zeer duidelijke reden is om het buiten dat bereik te houden.
Nog een opmerking over temperaturen: een kleine temperatuurschommeling is niet per se ongewenst. Hoewel temperatuurstabiliteit als een wenselijke eigenschap klinkt, en in sommige gevallen ook zo is, hebben onderzoeken aangetoond dat organismen die gewend zijn aan dagelijkse temperatuurschommelingen beter in staat zijn om te gaan met onverwachte temperatuurschommelingen. Dus hoewel een koraal of vis die normaal op 26°C gehouden wordt, heel gezond kan zijn, kan hetzelfde dier dat is aangepast aan een bereik van 25°C tot 28°C beter in staat zijn om te gaan met een aquarium dat per ongeluk stijgt tot 30°C.
pH
pH is een maat voor de concentratie van protonen (H+ ionen) en hydroxide (OH-) ionen in het water. Aquariumliefhebbers besteden aanzienlijke veel tijd en moeite aan het zich zorgen maken over, en proberen op te lossen van schijnbare problemen met de pH van hun aquaria. Een deel van deze inspanning is gerechtvaardigd, aangezien echte pH-problemen kunnen leiden tot een slechte diergezondheid. In veel gevallen is het enige probleem echter de pH-meting of de interpretatie ervan. Bovendien zorgt het handhaven van de juiste alkaliteit in zeewater er in grote mate voor dat de pH acceptabel is, met slechts een paar uitzonderingen die hieronder zullen worden besproken.
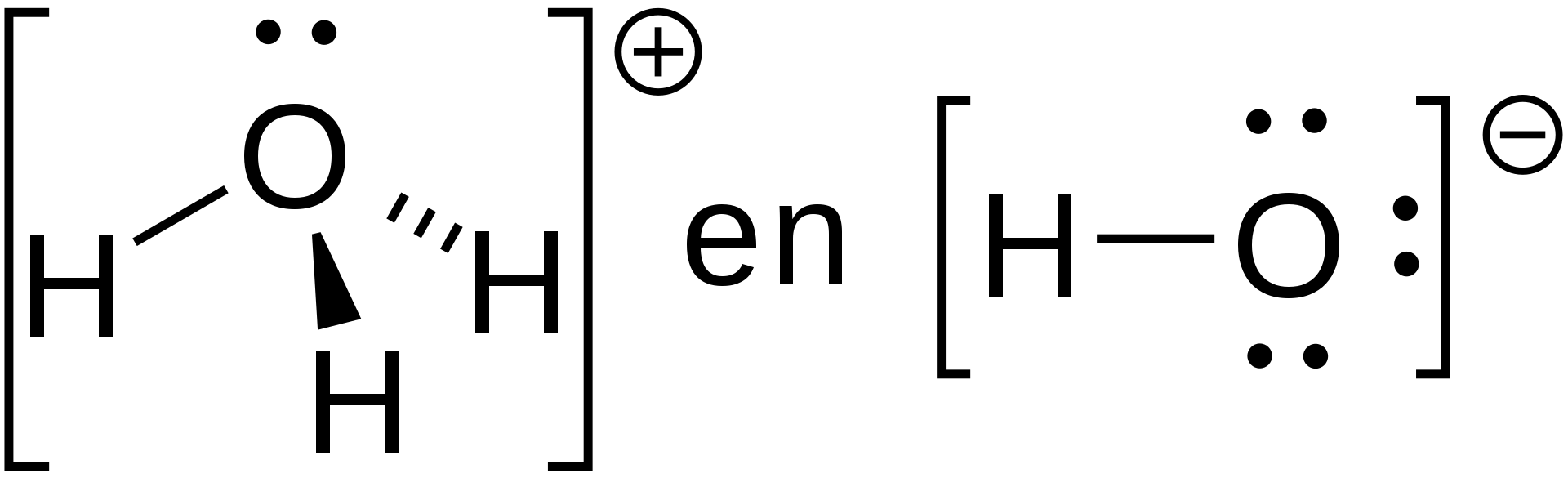
Hydroxonium ion en hydroxide ion. Door Leonwitte - Eigen werk, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=71600891
Verschillende factoren maken het controleren van de pH-waarde van een zeeaquarium nuttig. Een daarvan is dat waterorganismen alleen gedijen in een bepaald pH-bereik, dat van organisme tot organisme varieert. Het is daarom moeilijk om de bewering te rechtvaardigen dat een bepaald pH-bereik “optimaal” is in een aquarium met veel soorten.
Zelfs de pH van natuurlijk zeewater (8,0 tot 8,3) is misschien niet optimaal voor sommige van zijn bewoners, maar meer dan tachtig jaar geleden werd erkend dat een andere pH-waarde dan natuurlijk zeewater (bijvoorbeeld tot 7,3) stressvol is voor vissen.
Er bestaat nu aanvullende informatie over optimale pH-bereiken voor veel organismen, maar de gegevens zijn ontoereikend om aquariumliefhebbers in staat te stellen de pH te optimaliseren voor de meeste organismen die hen interesseren.
Bovendien kan het effect van pH op organismen direct of indirect zijn. Het is bekend dat de toxiciteit van metalen zoals koper en nikkel voor sommige aquariumorganismen, zoals mysiden en amfipoden, varieert met de pH. Bijgevolg kan het aanvaardbare pH-bereik van het ene aquarium verschillen van dat van een ander aquarium, zelfs als ze dezelfde organismen bevatten, maar verschillende concentraties metalen hebben.
Veranderingen in pH hebben niettemin een aanzienlijke invloed op sommige fundamentele processen die plaatsvinden in veel mariene organismen. Een van deze fundamentele processen is verkalking, of afzetting van calciumcarbonaatskeletten, waarvan bekend is dat deze afhankelijk is van de pH en gewoonlijk daalt als de pH daalt. Bij een voldoende lage pH (ergens onder pH 7,7) kunnen koraalskeletten langzaam beginnen op te lossen. Met behulp van dit soort informatie, samen met de geïntegreerde ervaring van veel hobbyisten, kunnen we enkele richtlijnen ontwikkelen over wat een acceptabel pH-bereik is voor rifaquaria en welke waarden de grenzen verleggen.
Het acceptabele pH-bereik voor rifaquaria is eerder een mening dan een duidelijk feit, en zal zeker variëren met de aanbieder van de mening. Dit bereik kan ook behoorlijk afwijken van het “optimale” bereik. Het rechtvaardigen van wat optimaal is, is echter veel problematischer dan het rechtvaardigen van dat wat gewoon acceptabel is, dus zullen we ons op het laatste concentreren. Als doel zou ik willen voorstellen dat de pH van natuurlijk zeewater, ongeveer 8,2, geschikt is, maar koraalrifaquaria kunnen duidelijk slagen in een groter bereik van pH-waarden. Naar mijn mening is het pH-bereik van 7,8 tot 8,5 een acceptabel bereik voor rifaquaria.
In werkelijkheid meten veel aquariumliefhebbers nooit de pH, en velen die dit doen, doen niets met de resultaten die ze verkrijgen. Dit gebrek aan actie is meestal oké, aangezien de meeste aquaria van nature niet buiten de aanvaardbare grenzen vallen. Tijden waarop het het belangrijkst is om in ieder geval af en toe de pH te controleren zijn:
1 Bij gebruik van additieven met een zeer hoge pH, zoals kalkwater. In dit geval moet men ervoor zorgen dat de pH niet boven ongeveer 8,55 komt. Bij hogere waarden kan de neerslag van calciumcarbonaat op pompen en dergelijke excessief worden. Elke pH-stijging van 0,3 pH-eenheid komt overeen met ongeveer een verdubbeling van de calcium- of alkaliteitswaarde in termen van de waarschijnlijkheid van neerslag van calciumcarbonaat (omdat bicarbonaat in carbonaat verandert naarmate de pH stijgt, waardoor neerslag wordt veroorzaakt). Aquaria kunnen vaak een pH bereiken die hoog genoeg is om de neerslagsnelheid te verdubbelen als gevolg van een verhoogde pH, maar men ziet niet vaak aquaria met calcium of alkaliteit die het dubbele is van de normale waarde, waardoor een hoge pH een grote aanjager van neerslag is.
2 Wanneer de lucht rond het aquarium een verhoogd kooldioxidegehalte heeft, zoals in een nieuwer, strakker huis. Lage pH als gevolg van verhoogde koolstofdioxide in de lucht is ZEER gebruikelijk. Hoewel het nuttig kan zijn om ervoor te zorgen dat de pH boven 8,0 blijft, zijn er veel fijne aquaria met de onderkant van het pH-bereik bij pH 7,8. Onder die waarde zou ik agressiever willen handelen, zoals meer frisse lucht in huis, afvullen met kalkwater, een verse luchtleiding van buiten naar de inlaat van de eiwitafschuimer, of een CO2-filter op de inlaat van de eiwitafschuimer.
Magnesium
Het belangrijkste belang van magnesium is de interactie met de calcium- en alkaliteitsbalans in rifaquaria. Zeewater en rifaquariumwater zijn altijd oververzadigd met calciumcarbonaat. Dat wil zeggen, de calcium- en carbonaatniveaus van de oplossing overschrijden de hoeveelheid die het water in evenwicht kan houden. Hoe kan dat zijn? Magnesium is een groot deel van het antwoord. Wanneer calciumcarbonaat begint neer te slaan, bindt magnesium zich aan het groeioppervlak van de calciumcarbonaatkristallen. Het magnesium verstopt effectief het groeiende kristaloppervlak, zodat ze niet langer op calciumcarbonaat lijken, waardoor het niet meer calcium en carbonaat kan aantrekken, zodat de neerslag stopt. Zonder het magnesium zou de abiotische (niet-biologische) neerslag van calciumcarbonaat waarschijnlijk voldoende toenemen om het behoud van calcium en alkaliteit op natuurlijke niveaus te voorkomen.
Om deze reden stel ik voor om de natuurlijke zeewaterconcentratie van magnesium te richten op circa 1285 ppm. Voor praktische doeleinden is 1250 tot 1350 ppm prima, en niveaus die iets buiten dat bereik (1250 tot 1400 ppm) liggen, zijn waarschijnlijk ook acceptabel. Hogere niveaus kunnen prima zijn, maar er is geen reden om het hoger te houden, met uitzondering van het proberen om Bryopsis te doden met bepaalde magnesiumsupplementen (die mogelijk werken vanwege een onzuiverheid in plaats van het magnesium zelf). Ik zou niet aanraden om magnesium onder normale omstandigheden met meer dan 100 ppm per dag te verhogen, voor het geval het magnesiumsupplement giftige onzuiverheden bevat. Als u het met enkele honderden ppm moet verhogen, kunt u door de toevoeging over meerdere dagen te spreiden, de doelconcentratie nauwkeuriger bereiken.

Zuiver magnesium. Foto: Jurii - http://images-of-elements.com/magnesium.php , CC BY 3.0, https://commons.wikimedia.org/w/index.php?curid=6889177
De koralen en koraalalgen van een aquarium kunnen magnesium uitputten door het op te nemen in hun groeiende calciumcarbonaatskeletten.
Veel methoden om calcium en alkaliteit aan te vullen, leveren mogelijk niet genoeg magnesium om het op een normaal niveau te houden. Bezonken kalkwater heeft bijvoorbeeld een behoorlijk magnesiumtekort in vergelijking met een koraalskelet.
Daarom moet magnesium af en toe worden gemeten, vooral als de calcium- en alkaliteitsniveaus van het aquarium moeilijk te handhaven lijken. Aquaria met overmatige abiotische neerslag van calciumcarbonaat op objecten zoals verwarmingen en pompen kunnen last hebben van lage magnesiumgehaltes (samen met een hoge pH, calcium en alkaliteit). Over het algemeen is magnesium meestal uitgeput met ongeveer 10% van de snelheid van calciumuitputting, of minder, afhankelijk van de dieren in het aquarium.
Veel mensen hebben nooit magnesiumsupplementen nodig. Sommige zoutmengsels beginnen zo hoog dat het nooit onder het natuurlijke niveau zal dalen, en sommige calcium- en alkaliteitssupplementen, zoals een tweedelig systeem van goede kwaliteit, voegen genoeg magnesium toe om niet te verminderen.
Fosfaat
De “eenvoudigste” vorm van fosfor in rifaquaria en in natuurlijk zeewater is anorganisch orthofosfaat (H3PO4, H2PO4-, HPO42- en PO43- zijn allemaal vormen van orthofosfaat). Anorganisch orthofosfaat is de enige vorm van fosfor die de meeste testkits meten, inclusief de verkeerd genoemde Hanna “fosfor”-checker. Bijna geen van deze kits meet organisch fosfaat, zoals aanwezig in eiwitten, DNA en fosfolipiden.
De anorganische fosfaatconcentratie in zeewater varieert sterk van plaats tot plaats, ook met diepte en met het tijdstip van de dag. Oppervlaktewateren zijn sterk fosfaatarm in vergelijking met diepere wateren, als gevolg van biologische activiteiten in de oppervlaktewateren die fosfaat in organismen vastleggen. Typische fosfaatconcentraties op het oceaanoppervlak zijn erg laag volgens typische normen voor het houden van riffen, soms zo laag als 0,005 ppm.
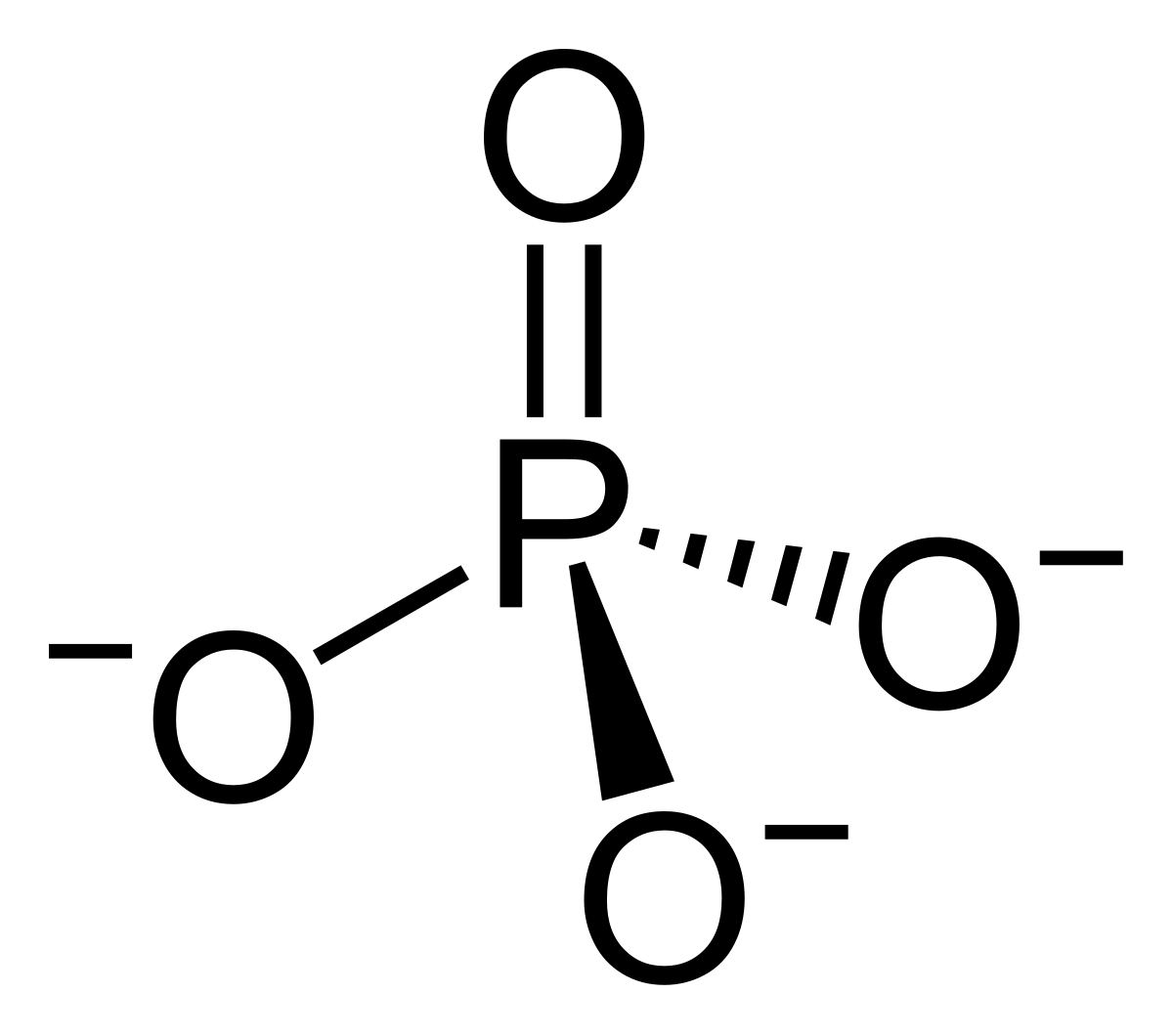
Structuurformule van het fosfaation (PO43-)
Zonder specifieke inspanningen om het fosfaatgehalte te minimaliseren, zal het zich typisch ophopen en stijgen in rifaquaria. Het wordt meestal geïntroduceerd met voedsel, maar kan ook binnenkomen met aanvullend water en in sommige calcium- en alkaliteitssupplementen. Zelden hoeft men echter verder te kijken dan voedsel als de primaire bron.
Als fosfaat boven het natuurlijke niveau komt, kan het twee ongewenste resultaten veroorzaken. Een daarvan is remming van verkalking. Dat wil zeggen, het kan de snelheid verminderen waarmee koralen en verkalkte algen calciumcarbonaatskeletten kunnen bouwen, waardoor hun groei mogelijk wordt belemmerd.
Fosfaat kan ook een beperkende voedingsstof zijn voor algengroei. Als fosfaat zich ophoopt, kan algengroei problematisch worden. Bij concentraties onder ongeveer 0,03 ppm is de groeisnelheid van bijvoorbeeld veel soorten fytoplankton afhankelijk van de fosfaatconcentratie (ervan uitgaande dat iets anders de groei niet beperkt, zoals stikstof of ijzer). Boven dit niveau is de groeisnelheid van veel van de organismen in de oceaan onafhankelijk van de fosfaatconcentratie (hoewel deze relatie gecompliceerder is in een rifaquarium dat ijzer- en/of stikstofbronnen zoals nitraat boven natuurlijke niveaus bevat). Dus om algengroei tegen te gaan door fosfaat te beheersen, moet het fosfaatgehalte vrij laag worden gehouden.

Fosfaat pocket fotometer van Hanna Instruments
Om deze redenen raad ik aan om fosfaat op 0,03 ppm of lager te houden. Of het onder 0,01 ppm houden substantiële extra voordelen zal opleveren, kan afhankelijk zijn van het specifieke aquarium, maar dat is een doel dat sommige aquariumliefhebbers nastreven met verschillende manieren om fosfaat te exporteren. Het is ook mogelijk om fosfaat te laag te drijven, wat kan resulteren in bleke koralen. In zo’n geval kan het heel nuttig zijn om fosfaat een beetje te laten stijgen, of de koralen van ander voedsel te voorzien. Aan de andere kant, hoewel er maar weinig zijn, zijn er een klein aantal zeer mooie aquaria met ZEER hoge fosfaatniveaus (meer dan 1,0 ppm). Hoe deze aquaria precies de problemen vermijden die andere aquaria hebben bij een hoog fosfaatgehalte, is niet bekend.
De beste manieren om een laag fosfaatgehalte in normale aquaria te behouden, zijn door een combinatie van fosfaatexportmechanismen op te nemen, zoals het kweken en oogsten van grasalgen, macroalgen of andere snelgroeiende organismen, het gebruik van voedsel zonder overmatig fosfaat, afschuimen, het gebruik van kalkwater, het gebruik van fosfaat bindmiddelen zoals GFO (granulair ijzeroxide; altijd bruin of zwart) en het gebruik van organische koolstofdosering (bijv. wodka, azijn, biopellets, enz.) om bacteriegroei te stimuleren.
Ammoniak
Ammoniak (NH3) wordt uitgescheiden door de meeste rifaquariumdieren en sommige andere aquariumbewoners. Helaas is het zeer giftig voor alle dieren, hoewel het niet giftig is voor bepaalde andere organismen, zoals sommige soorten macroalgen die het gemakkelijk consumeren. Vissen zijn echter niet de enige dieren die door ammoniak worden geschaad, en zelfs sommige algen worden aangetast door minder dan 0,1 ppm ammoniak.
In een gevestigd rifaquarium wordt de geproduceerde ammoniak meestal snel opgenomen.
Macroalgen gebruiken het om eiwitten, DNA en andere biochemicaliën te maken die stikstof bevatten. Bacteriën nemen het ook op en zetten het om in nitriet, nitraat en stikstofgas (de beroemde “stikstofcyclus”). Al deze verbindingen zijn veel minder giftig dan ammoniak (tenminste voor vissen), dus het ammoniakafval wordt onder normale omstandigheden snel “ontgiftigd”.
Onder bepaalde omstandigheden kan ammoniak echter een punt van zorg zijn. Tijdens de eerste opzet van een rifaquarium, of wanneer nieuw levend gesteente of zand wordt toegevoegd, kan een overvloed aan ammoniak worden geproduceerd die de beschikbare mechanismen niet snel genoeg kunnen ontgiften. In deze omstandigheden lopen vissen een groot risico. Ammoniakgehaltes van slechts 0,2 ppm kunnen gevaarlijk zijn voor vissen. In dergelijke gevallen moeten de vissen en ongewervelde dieren naar schoner water worden gebracht of het aquarium worden behandeld met een ammoniakbindend product zoals Amquel of Prime.
Veel aquariumliefhebbers zijn in de war door het verschil tussen ammoniak en een vorm ervan waarvan wordt aangenomen dat deze minder giftig is: ammonium. Deze twee vormen worden zeer snel omgezet (vele keren per seconde), dus voor veel doeleinden zijn het geen afzonderlijke chemicaliën. Ze zijn gerelateerd door de zuur-basereactie hieronder weergegeven:
NH3 + H+ ←→ NH4+
Ammoniak + waterstofion (zuur) ←→ ammoniumion
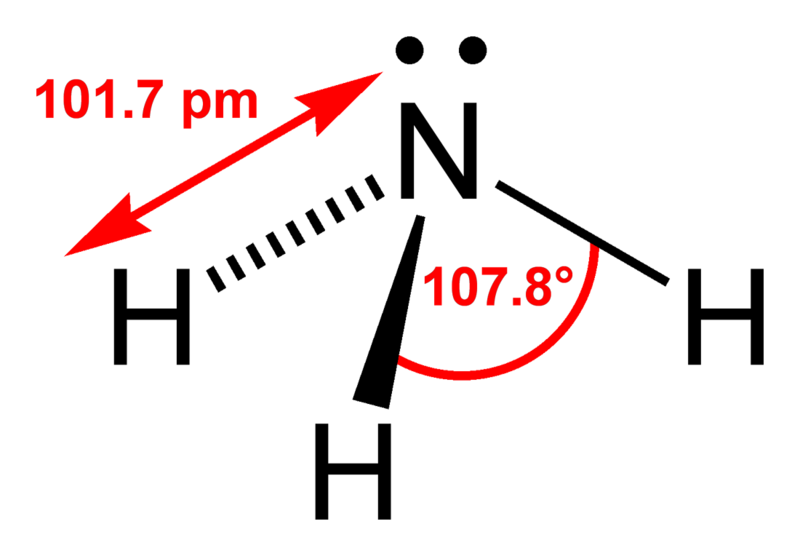
Structuurformule van ammoniak (NH3)
De reden dat ammonium minder toxisch wordt geacht dan ammoniak, is dat het als geladen molecuul de kieuwen van vissen passeert en langzamer in hun bloedbaan terechtkomt dan ammoniak, dat gemakkelijk door de kieuwmembranen gaat en snel in het bloed terechtkomt.
In aquaria met hogere pH-waarde, die minder H+ bevatten, hebben meer van de totale ammoniak in de NH3-vorm. Dientengevolge neemt de toxiciteit van een oplossing met een vaste totale ammoniakconcentratie toe naarmate de pH stijgt. Dit is van belang in gebieden zoals het vistransport, waar ammoniak kan oplopen tot giftige niveaus.
Aanbevelingsdetails: andere parameters
Kalium
Kalium wordt vermeld met de minder kritische parameters, niet omdat het niet belangrijk is, maar omdat het in de meeste aquaria niet snel uitgeput raakt. De meeste rifaquariumliefhebbers testen of doseren geen kalium en hebben waarschijnlijk voldoende hoeveelheden van alleen waterverversing. Kalium is belangrijk voor de cellulaire functie en is over het algemeen hoger in concentratie binnen in cellen dan buiten. Bij mensen bevindt het zich bijvoorbeeld bijna allemaal in cellen, met zeer lage concentraties in het bloed.

Kalium is in elementaire vorm zeer reactief en zal spontaan ontbranden in de lucht.
In mariene systemen hebben de meeste cellen van organismen een hogere kaliumconcentratie dan het omringende zeewater. Dan zou het lijken alsof kalium snel zou worden uitgeput als organismen groeien en weefselmassa toevoegen, of het nu bacteriën, microalgen, macroalgen, vissen of koralen zijn. Er zit echter vrij veel kalium in zeewater- en zoutmengsels, en de meeste voeders bevatten ook kalium. Ervan uitgaande dat deze cellen niet worden opengebroken en vrij worden gespoeld van kalium, komt er een grote hoeveelheid binnen met voedsel. Dus de netto-concentratie van kalium in het aquarium zal een balans zijn tussen het voedsel en andere toevoegingen, en de opname van weefselmassa (of het nu wordt geëxporteerd of in de aquarium wordt achtergelaten).
Een aantal aquariumliefhebbers heeft geconstateerd dat hun aquariums te weinig kalium bevatten en doseren het om het natuurlijke niveau te behouden. Ik heb niet ontdekt dat het in mijn aquarium uitgeput is en ik doseer er ook geen. Sommige mensen associëren uitputting met het doseren van organische koolstof om de groei van bacteriën te stimuleren, maar ik heb dat niet in mijn systeem gezien (misschien vanwege het voedsel dat ik kies om te voeren). Van degenen met uitgeput kalium lijkt het primaire symptoom bepaalde problemen te zijn met SPS-koralen zoals Montipora. Soms wordt het gerapporteerd als slechte groei en/of grijzige verkleuring. Ik weet niet of dat echt verband houdt met een laag kaliumgehalte, maar als je zo’n probleem hebt, kan het nuttig zijn om kalium te meten met een kit en zo nodig te doseren. Ik zou aanraden om ongeveer 380-420 ppm te handhaven, maar als het al hoger is dan dat niveau, zou ik niets doen om het te verlagen.
Silicium
Silicium roept twee problemen op. Als diatomeeën een voortdurend probleem vormen in een gevestigd rifaquarium, kunnen ze wijzen op een substantiële bron van oplosbaar silicium, met name kraanwater, aangezien diatomeeën silicium nodig hebben om te overleven. In dat geval zal het zuiveren van het kraanwater waarschijnlijk het probleem oplossen. In een dergelijke situatie kan het zijn dat testen geen verhoogde siliciumgehalten aan het licht brengen, omdat de diatomeeën het net zo snel kunnen gebruiken als het het aquarium binnenkomt.
Als diatomeeën geen probleem zijn, raad ik veel aquariumliefhebbers aan om silicaat (een beter oplosbare vorm van silicium) te doseren. Waarom zou ik aanraden om silicium te doseren? Grotendeels omdat de dieren in onze aquaria het gebruiken, zijn de concentraties in veel aquaria onder het natuurlijke niveau, en bijgevolg krijgen de sponzen, weekdieren en diatomeeën die in deze aquaria leven mogelijk niet genoeg silicium om te gedijen.
Ik raad aan om natriumsilicaatoplossing te doseren, omdat het een gemakkelijk oplosbare vorm van silicium is. Ik doseer een bulkkwaliteit natriumsilicaatoplossing (waterglas), wat erg goedkoop is. Mogelijk vindt u “waterglas” in winkels of online omdat sommige mensen het gebruiken voor het bewaren van eieren.
![]()
Close-up foto van een stuk gezuiverd silicium. Foto: www.commons.wikimedia.org.
Op basis van mijn ervaring met doseringen, zijn aquariumliefhebbers waarschijnlijk een veilige dosering van 1 ppm SiO2 eens in de 1 à 2 weken. Dit is gebaseerd op het feit dat mijn aquarium zoveel verbruikt in minder dan vier dagen zonder enige vorm van “slechte” reactie. Er is natuurlijk niets mis mee om te beginnen met een tiende van die dosering en deze geleidelijk op te voeren. Als u toch te veel diatomeeën krijgt, stop met doseren. Ik neem aan dat alle SiO2 die ik aan mijn aquarium heb toegevoegd door verschillende organismen is gebruikt (sponzen, diatomeeën, enz.), maar misschien heb ik meer sponzen dan andere aquariumliefhebbers.
Daarom kunnen diatomeeën in sommige aquaria een groter probleem zijn dan in de mijne. GFO (granulair ijzeroxide) dat wordt gebruikt om fosfaat te verminderen, heeft ook de neiging om silicaat te binden en de concentratie ervan te verlagen.
Als je ervoor kiest om silicaat te doseren, zou ik ook adviseren om af en toe de oplosbare siliciumconcentratie in het water te meten, voor het geval de vraag in je aquarium aanzienlijk minder is dan die van mij. Als de concentratie boven 3 ppm SiO2 zou stijgen, zelfs bij afwezigheid van diatomeeën, zou ik waarschijnlijk de dosering verlagen omdat dat dicht bij de maximale concentratie is die oppervlaktezeewater ooit bevat.
Jodium
Ik doseer momenteel geen jodium in mijn aquarium en raad anderen ook niet aan om dit noodzakelijkerwijs te doen zonder zelf te verifiëren dat het nuttig is in hun aquarium. Het doseren van jodium is ingewikkelder dan het doseren van andere ionen vanwege het grote aantal verschillende natuurlijk bestaande vormen, het aantal verschillende vormen dat aquariumliefhebbers daadwerkelijk doseren, het feit dat al deze vormen in rifaquaria kunnen worden omgezet en het feit dat de beschikbare test kits vaak slechts een gedeelte van de totale aanwezige vormen detecteren. Deze complexiteit, in combinatie met het feit dat er in de wetenschappelijke literatuur geen algemeen gehouden rifaquariumsoorten bekend zijn die veel jodium nodig hebben, suggereert dat dosering mogelijk onnodig en problematisch is.

Dijood (I2) kristallen. Foto www.wikipedia.org.
Ik heb jarenlang jodide gedoseerd en ben toen gestopt en heb nooit enig verschil gezien in de dieren die ik hield (inclusief macroalgen, garnalen, enz., Maar ik heb duidelijk nooit elk mogelijk dier gehouden dat anderen zouden kunnen houden). Vele anderen hebben die bevinding overgenomen. Weer anderen zijn er echter van overtuigd dat jodium nuttig is in hun aquarium.
Jodium in de oceaan bestaat in een grote verscheidenheid aan vormen, zowel organische als anorganische, en de jodiumcycli tussen deze verschillende verbindingen zijn zeer complex en vormen nog steeds een gebied van actief onderzoek. De aard van anorganisch jodium in de oceanen is al tientallen jaren algemeen bekend. De twee overheersende vormen zijn jodaat (IO3-) en jodide (I-). Samen vormen deze twee jodiumsoorten gewoonlijk ongeveer 0,06 ppm totaal jodium, maar de gerapporteerde waarden variëren met een factor van ongeveer twee. In oppervlaktezeewater domineert jodaat gewoonlijk, met typische waarden in het bereik van 0,04 tot 0,06 ppm jodium. Evenzo is jodide gewoonlijk aanwezig in lagere concentraties, typisch 0,01 tot 0,02 ppm jodium.
Organische vormen van jodium zijn alle vormen waarin het jodiumatoom covalent is gebonden aan een koolstofatoom, zoals methyljodide, CH3I. De concentraties van deze organische vormen (waarvan er veel verschillende moleculen zijn) worden nu pas erkend door oceanografen. In sommige kustgebieden kunnen organische vormen tot 40% van het totale jodium uitmaken, dus veel eerdere rapporten over verwaarloosbare niveaus van organische jodiumverbindingen kunnen onjuist zijn.
De primaire organismen in rifaquaria die jodium ‘gebruiken’, althans voor zover bekend in de wetenschappelijke literatuur, zijn algen (zowel micro als macro). Mijn experimenten met Caulerpa racemosa en Chaetomorpha sp. suggereren dat toevoegingen van jodide de groeisnelheid van deze macroalgen, die vaak worden gebruikt in rifaquaria, niet significant verhogen. Andere macroalgensoorten kunnen anders reageren, maar er is in de wetenschappelijke literatuur niet bekend dat ze jodium ‘nodig hebben’.
Tot slot, voor diegenen die geïnteresseerd zijn in het doseren van jodium, stel ik voor dat jodide de meest geschikte vorm is om te doseren. Jodide wordt door sommige organismen gemakkelijker gebruikt dan jodaat en wordt gedetecteerd door testkits. Hoewel veel mensen het gebruiken en blij zijn met de resultaten, ben ik geen fan van Lugols jodium (een mengsel van I2 en I-) omdat het reactief en onnatuurlijk is. Met dat als achtergrond, is mijn aanbeveling om met jodium te experimenteren als je wilt, maar wees erop voorbereid dat er geen voordeel zal zijn en stop als dat het geval lijkt. Om redenen die verband houden met de complexiteit van jodiumvormen en testen, raad ik aquariumliefhebbers gewoonlijk aan om niet te proberen een specifieke jodiumconcentratie te handhaven met behulp van toevoeging- en testkits, maar om ongeveer een keer per week zoiets als een NSW-equivalent te doseren.
Ik zou ook commerciële jodiumproducten met getimede afgifte vermijden. Ik weet niet wat een van deze producten eigenlijk zijn, maar hoogstwaarschijnlijk zijn ze een soort organisch jodium. Er zijn weinig gegevens beschikbaar over de effecten van dergelijke verbindingen in aquaria en ik zie geen reden om ermee te experimenteren.
Nitraat
Nitraat is een ion dat aquariumliefhebbers al lang achtervolgt.
Door recente innovaties is het een veel minder chronisch probleem geworden. De stikstof die het vormt komt binnen met voedsel en kan in veel aquaria nitraat genoeg verhogen om het moeilijk te maken om natuurlijke niveaus te handhaven. In het verleden voerden veel aquariumliefhebbers waterverversingen uit met nitraatreductie als een van hun primaire doelen. Gelukkig hebben we nu een groot aantal manieren om nitraat onder controle te houden, en moderne aquaria hebben veel minder last van een verhoogd nitraatgehalte dan die in het verleden.
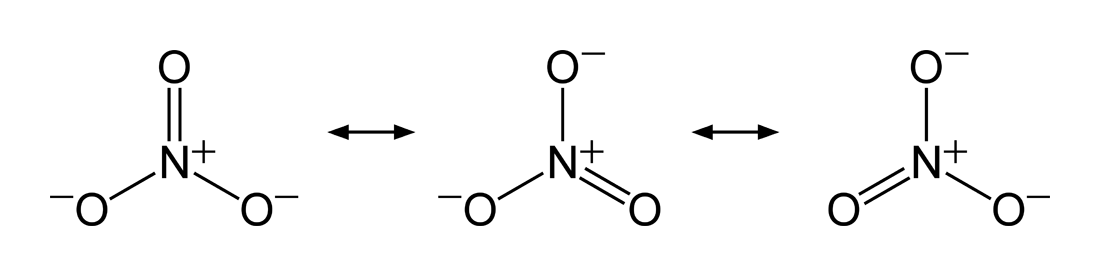
De drie mesomeren van het nitraation. Door Ben Mills - Eigen werk, Publiek domein, https://commons.wikimedia.org/w/index.php?curid=2658296
Nitraat wordt vaak geassocieerd met algen, en inderdaad wordt de groei van algen vaak gestimuleerd door overtollige voedingsstoffen, waaronder nitraat. Andere potentiële aquariumplagen, zoals dinoflagellaten, worden ook aangespoord door overtollig nitraat en andere voedingsstoffen. Nitraat zelf is niet acuut toxisch op de niveaus die gewoonlijk worden aangetroffen in rifaquaria, althans zoals tot nu toe bekend is in de wetenschappelijke literatuur.
Niettemin kunnen verhoogde nitraatniveaus de groei van zoöxanthellen overmatig stimuleren, wat op zijn beurt de groeisnelheid van hun gastheerkoraal kan verminderen en ze bruin kan maken.
Om deze redenen streven de meeste rifaquariumliefhebbers ernaar om het nitraatgehalte laag te houden. Een goede doelstelling is minder dan 0,2 ppm nitraat. Rifaquaria kunnen acceptabel functioneren bij veel hogere nitraatniveaus (zeg 20 ppm), maar lopen een groter risico op de hierboven beschreven problemen.
Er zijn veel manieren om nitraat te verminderen, waaronder het verminderen van de stikstoftoevoer van het aquarium, het verhogen van de stikstofexport door afschuimen, het verhogen van de stikstofexport door het kweken en oogsten van macroalgen of grasalgen (of een ander organisme naar keuze), met behulp van een diep zandbed, levend gesteente , het verwijderen van bestaande filters die ontworpen zijn om de stikstofkringloop te vergemakkelijken, het gebruik van een koolstofdenitrator, het gebruik van een zwaveldenitrator, het gebruik van organische koolstofdosering (azijn, wodka, biopellets, enz.), het gebruik van nitraatabsorberende vaste stoffen en het gebruik van polymeren en actieve kool die organische stoffen binden voordat ze kapot gaan. Ik gebruik er veel van: azijn doseren, afschuimen, macroalgen kweken, veel levend gesteente in refugia en actieve kool.
Nitriet
De zorgen van aquariumliefhebbers over nitriet worden meestal geïmporteerd uit de zoetwaterhobby. Nitriet is veel minder giftig in zeewater dan in zoet water. Vissen kunnen doorgaans overleven in zeewater met meer dan 100 ppm nitriet! Tenzij toekomstige experimenten aanzienlijke nitriettoxiciteit voor rifaquariumbewoners aantonen, beschouw ik nitriet niet als een belangrijke parameter voor rifaquariumliefhebbers om te controleren. Het volgen van nitriet in een nieuw rifaquarium kan desalniettemin leerzaam zijn door de biochemische processen die plaatsvinden te laten zien. In de meeste gevallen raad ik aquariumliefhebbers niet aan om nitriet te meten in gevestigde aquaria.
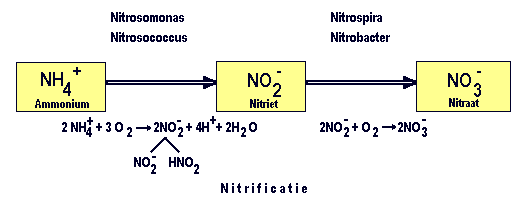
Van ammoniak naar nitraat door nitrificatie. Foto: Aquainfo.nl
Strontium
Strontium is een ander ion dat in het verleden erg belangrijk werd geacht, maar toen veel mensen stopten met doseren, bleek er niets te gebeuren. Er zijn zeker nog steeds aanhangers die geloven dat het nuttig is in hun aquaria, maar zoals jodium, als je het doseert, doe het dan als een experiment en kijk of het nuttig is in plaats van aan te nemen dat het nuttig is en veel tijd en geld te besteden aan het monitoren en het beheersen.
Als u ervoor kiest om het te doseren, is mijn aanbeveling om het strontiumgehalte in het bereik van 5-15 ppm te houden. Dat niveau overspant ongeveer het niveau in natuurlijk zeewater van 8 ppm. Ik raad aquariumliefhebbers niet aan om strontium aan te vullen, tenzij ze strontium hebben gemeten en hebben geconstateerd dat het op is. Ik heb onlangs geen strontium-testkits geëvalueerd, maar sommige die ik in het verleden heb gebruikt, waren niet erg bevredigend. Hopelijk is dat veranderd, maar als dat niet het geval is, wordt het beheersen van strontium nog uitdagender.

Strontium in dendritische vorm, zwaar geoxideerd, enige metaalachtige glans is zichtbaar. Foto: de originele uploader was Tomihahndorf op de Duitstalige Wikipedia - Verplaatst vanaf de.wikipedia naar Commons., CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=1744214
In sommige tests die ik in het verleden deed (geen kit maar een ICP-AES-instrument gebruikt), ontdekte ik dat in mijn rifaquarium, zonder enige toevoeging van strontium, strontium al boven natuurlijke niveaus was verhoogd (tot 15 ppm vanwege verhoogde strontium in de Instant Ocean-zoutmix die ik gebruikte). Ik zou het niet graag nog hoger zien. Daarom is het niet raadzaam om een supplement toe te voegen zonder het huidige strontiumgehalte van het aquarium te kennen. Wetenschappelijk bewijs geeft aan dat sommige organismen strontium nodig hebben, zij het niet de organismen die de meeste rifhouders in stand houden. Bepaalde buikpotigen, koppotigen en radiolaria hebben bijvoorbeeld strontium nodig. Het is echter duidelijk toxisch bij verhoogde concentraties. In één gerapporteerd geval was 38 ppm voldoende strontium om een bepaalde krabsoort (Carcinus maenas) te doden.
Er zijn geen aanwijzingen dat 5-15 ppm strontium schadelijk is voor welk marien organisme dan ook, hoewel het niet bekend is welke strontiumniveaus optimaal zijn. Ten slotte suggereert anekdotisch bewijs van een aantal gevorderde aquariumliefhebbers dat strontium dat aanzienlijk onder het natuurlijke niveau ligt, schadelijk is voor de groei van koralen die veel aquariumliefhebbers houden, maar dit effect is niet bewezen.
Strontium kan uitgeput raken in rifaquaria omdat het er chemisch uitziet als calcium, en “per ongeluk” wordt opgenomen in calciumcarbonaat terwijl het neerslaat, hetzij op pompen en verwarmingen, hetzij in koraalskeletten. Voor veel aquariumliefhebbers is het verversen van water met een zoutmengsel met een geschikt strontiumgehalte wellicht de beste manier om strontium op het juiste niveau te houden.
Redox
Ik raad aquariumliefhebbers niet aan om redox te “controleren”.
Het oxidatiereductiepotentieel (ORP of Redox) van een zeeaquarium is een maat voor het relatieve oxiderende vermogen van het water. Redox is vaak aanbevolen aan aquariumliefhebbers als een belangrijke waterparameter, en sommige bedrijven verkopen producten (apparatuur en chemicaliën) die zijn ontworpen om de redox te beheersen. Velen die redox-controle hebben aanbevolen, hebben aquariumliefhebbers ervan overtuigd dat het een maatstaf is voor de relatieve “zuiverheid” van het aquariumwater, ondanks dat dit nooit is aangetoond
Een redoxreactie kan algemeen als volgt worden voorgesteld:
Reductor → reactieproduct + e− (oxidatie)
Oxidator + e− → reactieproduct (reductie)
Redox is in wezen heel, heel ingewikkeld. Het is misschien wel het meest gecompliceerde chemische kenmerk van zeeaquaria dat aquariumliefhebbers doorgaans tegenkomen. Redox bevat veel chemische details die eenvoudigweg onbekend zijn, zowel voor zeewater als voor aquaria. Het gaat om processen die niet in evenwicht zijn en dus moeilijk te begrijpen en te voorspellen zijn. Nog ontmoedigender is het feit dat de chemicaliën die de redox in het ene aquarium beheersen, misschien niet eens dezelfde chemicaliën zijn die de redox in een ander aquarium of in natuurlijk zeewater beheersen. In veel zeewatersituaties kan de gemeten redoxwaarde feitelijk de relatieve concentratie van de verschillende redoxvormen van verschillende metalen, zoals ijzer en mangaan, meten.
Redox is echter een interessante maatstaf voor de eigenschappen van water in een zeeaquarium. Het heeft toepassingen voor het bewaken van bepaalde gebeurtenissen in aquaria die van invloed zijn op de redox, maar die anders moeilijk te detecteren zijn. Deze gebeurtenissen kunnen onmiddellijke dood van organismen omvatten, evenals stijgingen op lange termijn van de niveaus van organische materialen. Aquariumliefhebbers die de redox controleren en die andere dingen doen die geschikt lijken voor het onderhoud van een aquarium in reactie op de redoxwaarde (zoals het verhogen van beluchting, afschuimen, gebruik van koolstof, enz.), kunnen het monitoren van redox een nuttige manier vinden om vooruitgang te zien.
Redoxmetingen zijn echter zeer gevoelig voor fouten. Aquariumliefhebbers worden sterk gewaarschuwd om niet te veel nadruk te leggen op absolute redoxwaarden, vooral als ze hun redoxsonde niet recentelijk hebben gekalibreerd. In plaats daarvan zijn redoxmetingen het nuttigst als we kijken naar veranderingen in gemeten redox in de loop van de tijd.
Sommige aquariumliefhebbers gebruiken oxidatiemiddelen (zoals een permanganaat) om redox te verhogen, hoewel deze praktijk nu veel minder gebruikelijk is dan in de begindagen van het houden van rifaquaria. Deze toevoegingen kunnen sommige aquaria ten goede komen en kunnen gunstig zijn op manieren die niet alleen worden aangetoond door veranderingen in redox (bijvoorbeeld door de geelheid van het water te verminderen). Ik heb dergelijke materialen nog nooit rechtstreeks aan mijn aquarium toegevoegd, hoewel ik in het verleden ozon heb gebruikt. Bij gebrek aan overtuigende andere gegevens, lijken dergelijke toevoegingen mij potentieel riskanter dan wordt gerechtvaardigd door hun aangetoonde en veronderstelde voordelen (behalve voor correct gebruikt ozon).
Redox is belangrijk als u ervoor kiest ozon te gebruiken als een indicator dat u niet te veel gebruikt en daardoor uw dieren in gevaar brengt. Naar mijn mening is de absolute redoxwaarde echter niet eens een goede indicator dat u een geschikte hoeveelheid ozon gebruikt. Voor dat doel kan de verandering in redox van voor naar na het ozongebruik geschikter zijn.
Borium
Het belang van borium in zeeaquaria is een onderwerp dat niet vaak wordt besproken door hobbyisten, ondanks het feit dat sommige mensen het dagelijks doseren met hun commerciële alkaliteitstoevoegingen. Het meeste commentaar op borium is in feite afkomstig van fabrikanten die het op de een of andere manier verkopen als een “buffermiddel”. Deze discussies missen helaas bijna altijd een kwantitatieve discussie over borium of de effecten ervan, zowel positief als negatief. In het algemeen is borium naar mijn mening geen belangrijk element om te bestrijden in aquaria.
Borium, dat aanwezig is als boorzuur en boraat in zeewater, draagt slechts een kleine fractie bij aan de pH-buffercapaciteit van normaal zeewater, waarbij bijna alle buffering afkomstig is van het bicarbonaat/carbonaatbufferpaar. Boraat lijkt voor bepaalde organismen een noodzakelijke of wenselijke voedingsstof te zijn, maar is ook giftig voor andere op niveaus die niet ver boven de natuurlijke niveaus liggen.
Om deze redenen is mijn aanbeveling om ongeveer natuurlijke boorniveaus te handhaven, ongeveer 4,4 ppm borium. Elke waarde onder 10 ppm is waarschijnlijk acceptabel voor de meeste aquaria. Waarden boven 10 ppm moeten worden vermeden.

Borium. Door Jurii - http://images-of-elements.com/boron.php, CC BY 3.0, https://commons.wikimedia.org/w/index.php?curid=6889727
De meeste rifaquaria krijgen waarschijnlijk voldoende borium uit hun zoutmengsels en waterverversingen, en in het algemeen raad ik de meeste aquariumliefhebbers niet aan om te proberen het niveau specifiek te regelen. Het lijkt in de meeste aquaria niet snel uitgeput te raken.
Ijzer
De ijzerconcentratie is laag genoeg om de groei van fytoplankton in delen van de oceaan te beperken, en kan beperkend zijn voor macroalgen en grasalgen in veel rifaquaria. Vanwege de beperkte voorraad en het cruciale belang, is het ook onderhevig aan agressieve opslag door bacteriën, algen en andere mariene organismen.
Daarom kunnen aquariumliefhebbers overwegen ijzer te doseren als ze macroalgen kweken of een algenrefugium hebben, en mogelijk zelfs als ze dat niet doen.
IJzer is niet gemakkelijk te meten op niveaus die normaal worden aangetroffen in de oceaan of in zeeaquaria. Kits kunnen niet laag genoeg zijn om de betrokken lage niveaus te detecteren, tenzij het in ongewoon grote hoeveelheden wordt gedoseerd. Het is ook niet eenvoudig om te bepalen welke van de vele vormen biologisch beschikbaar zijn in zeewater en welke niet.

Zuivere (99,97%+) elektrolytisch geraffineerde stukjes ijzer met ter vergelijking een ultra-pure (99,9999% = 6N) ijzeren kubus van 1 kubieke centimeter. 6N staat hierbij voor 6 negens (99,9999). Foto: Alchemist-hp (talk) (www.pse-mendelejew.de) op commons.wikimedia.org.
Daarom moeten aquariumliefhebbers zich niet richten op een specifieke concentratie, maar moeten ze eerder beslissen of ze die überhaupt willen doseren, en vervolgens een redelijke dosering gaan gebruiken om de effecten te observeren. De reden om ijzer te doseren is dat macroalgen en grasalgen er baat bij kunnen hebben.
Als u deze algen niet kweekt, hoeft u mogelijk helemaal geen ijzer te controleren of te doseren.
Het is vrij eenvoudig om te beslissen hoeveel ijzer je moet toevoegen, omdat het, naar mijn ervaring, niet zoveel uitmaakt. Vermoedelijk, als je eenmaal genoeg hebt toegevoegd om het als beperkende voedingsstof te elimineren, veroorzaakt extra ijzer in de meeste gevallen geen duidelijke schade (hoewel er sommige mensen zijn die denken dat het de groei van cyanobacteriën kan stimuleren). Jarenlang heb ik een ijzercitraatoplossing gedoseerd, maar recentelijk ben ik overgestapt op een oplossing die gemaakt is door één Fergon-tablet (ferrogluconaat; een ijzersupplement voor mensen verkrijgbaar in drogisterijen) op te lossen in ongeveer 20 ml gedemineraliseerd water. De tablet valt uiteen na een nacht inweken. Daarna schud ik het mengsel door elkaar, laat eventuele vaste stoffen bezinken en doseer een of twee keer per week ongeveer 1-2 ml van deze heldere groenachtige vloeistof aan mijn systeem met een totaal watervolume van ongeveer 1.100 liter.
Als je een commercieel ijzersupplement koopt, raad ik aan om alleen ijzersupplementen te gebruiken die ijzer bevatten dat is gechelateerd tot een organisch molecuul. Het ijzer dat wordt verkocht voor zoetwatertoepassingen is soms niet gechelateerd omdat vrij ijzer beter oplosbaar is in de lagere pH van zoetwateraquaria. Ik zou die producten in maritieme toepassingen vermijden. Het zal waarschijnlijk nog steeds werken, aangezien veel van de onderzoeken in de wetenschappelijke literatuur vrij ijzer in zeewater gebruiken, maar waarschijnlijk niet zo goed omdat het kan neerslaan voordat het het systeem volledig met ijzer heeft versterkt.
In veel gevallen van ijzerproducten die bedoeld zijn voor de maritieme hobby, vermeldt het product mogelijk niet waarmee het ijzer is gechelateerd, om gepatenteerde formuleringen te beschermen. Ik weet eigenlijk niet of het veel uitmaakt. Zeer sterke chelatie door bepaalde moleculen zal de biologische beschikbaarheid in feite remmen door de afgifte van het ijzer te verbieden, tenzij het chelerende molecuul volledig uit elkaar wordt gehaald, maar ik verwacht dat fabrikanten die moleculen hebben vermeden. EDTA, citraat en enkele andere worden fotochemisch afgebroken, waarbij voortdurend kleine hoeveelheden vrij ijzer vrijkomen. Er wordt aangenomen dat het het vrije ijzer is dat veel van de organismen daadwerkelijk opnemen.
Opgemerkt moet worden dat ijzer een beperkende factor kan zijn voor veel andere organismen dan macroalgen. Deze kunnen microalgen, bacteriën (zelfs pathogene bacteriën), cyanobacteriën en diatomeeën omvatten. Als er zich onverwachte problemen voordoen, kan het gerechtvaardigd zijn om de ijzertoevoeging te staken of te stoppen.
Samenvatting
Chemische problemen in rifaquaria zijn vaak ontmoedigend voor aquariumliefhebbers. Er zijn veel chemische parameters die aquariumliefhebbers controleren, waarvan sommige cruciaal zijn voor succes en waarvan sommige veel minder belangrijk zijn. Van degenen die cruciaal zijn voor succes, vereisen alleen calcium en alkaliteit regelmatige toevoeging in de meeste rifaquaria, hoewel de andere in Tabel 1 mogelijk moeten worden gecontroleerd. Door de parameters in Tabel 1 met succes op het juiste niveau te houden, zou een grote bijdrage moeten worden geleverd om aquariumliefhebbers in staat te stellen ten volle te genieten van hun aquaria en er tegelijkertijd voor te zorgen dat de bewoners goed worden verzorgd.
Bron:
https://www.reef2reef.com/ams/optimal-parameters-for-a-coral-reef-aquarium-by-randy-holmes-farley.79/
Noot van de redactie ReefSecrets: Ter aanvulling van dit artikel kan ik ten zeerste het volgende boek aanbevelen: Ratgeber Meerwasserchemie, Theorie & Praxis für Aquarianer van Armin Glaser, ISBN 978-3-9810570-2-7. Voor nog geen 30 euro kun je het wel vinden in de aquariumhandel of via een webshop
















